
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Система відліку повних ентальпійСодержание книги
Поиск на нашем сайте Чисельне значення величини повної теплоємності залежить від прийнятої системи її відліку. У літературі, присвяченій розрахункам PРД чи взагалі розрахункам температури і складу продуктів згоряння, зустрічаються різні способи відліку тепловмісту. Запропоновані системи відліку повних ентальпій відрізняються за двома основними ознаками: 1. Приймають різну початкову температуру відліку фізичних тепловмістів Т0 . 2. У різних системах умовно хімічну енергію відносять до різних речовин. Її можна відносити або до горючих елементів, або до окислювальних елементів, або до речовини яка утворилась. Крім того, хімічній енергії може бути, як ми вже говорили, приписаний різний знак. Пояснимо сказане прикладом. Утворення води відбувається за відомим рівнянням:
При цьому виділяється енергія, рівна -242,18 кДж/г-моль, і записане рівняння має вигляд:
Виділену енергію можна віднести до пального елементу, тобто, водню, і якщо надати їй додатний знак, то отримаємо так звану теплотворну здатність водню. У цьому випадку хімічні енергї кисню О2 і води H2О будуть рівні нулю. Так само виділену енергію можна віднести до окислювального елемента – кисню О2 або до утвореної речовини H2O, вважаючи хімічну енергію двох інших компонентів рівною нулю. Найбільш логічно відносити виділену або витрачену під час протікання реакції енергію до утвореної речовини. Під час проведення теплових розрахунків вибір тієї чи іншої системи відліку тепловмісту не є суттєвим, тільки необхідно розрахунок повних тепловмістів пального, окислювача, палива і продуктів згоряння проводити в одній системі відліку. У подальших позрахунках будемо використовувати систему відліку, запропоновану А. П. Ванічевим. У цій системі відліку: 1. Хімічну енергію виділену або затрачену під час протікання реакції, відносять до утвореної у результаті реакції речовини. У зв'язку з цим хімічна енергія стандартних елементів дорівнює нулю. 2. Хімічну енергію речовини враховують шляхом введення в повне теплоутворення величини її теплоти утворення за 293 К,тобто величини ∆Н293 . Такий спосіб оцінки величини хімічної анергії не вносить жодних похибок у розрахунки (якщо їх виконувати в одній системі), але зручний тим, що теплота утворення речовин найчастіше визначають саме за цієї температури. 3. Хімічна енергія вважається позитивною, якщо вона затрачена на утворення речовини, і негативною, якщо вона при цьому виділяється. 4. За нуль відліку фізичних тепловмістів приймають температуру 293 К. Таким чином, у використаній системі відліку повних тепловмістів величина In для речовини, що має температуру Т, буде визначатися співвідношенням
а для рідких речовин
У зв'язку із зазначеними вище умовами повний тепловмніст компонентів палива за температури 293 К дорівнює їх теплоті утворення Величини хімічної енергії і повного тепловмісту у системі А. П. Ванічева (теплоти утворення Повний тепловміст стандартних елементів за 293 К дорівнює нулю. За цієї ж температури повні тепловмісти продуктів, які можуть утворитися в камері РРД (СО2; Н2О; HF; СО; ОН; N0; Н; О; F; N), рівні їх теплоті утворення. Як показують дані табл. 2.2, повний тепловміст за 293 К дуже близький до величини хімічної енергій. При цьому для продуктів згоряння (СО2; Н2О; HF і СО) за 293 К величина Iп негативна, а для інших газів – позитивна.
Таблиця 2.2 Хімічна енергія (∆Н0) і повний тепловміст у системі А. П.Ванічева за 293 К стандартних пальних і окислювальних елементів, а також продуктів згоряння і продуктів дисоціації палив РРД
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 164; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.22.68 (0.008 с.) |

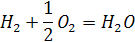

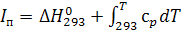 ,
,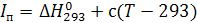
 . Оскільки у більшості випадків температура, за якої компоненти палива використовують у двигуні, дорівнює 293 К або близька до неї, величина повного тепловмісту компонентів палива в основному характеризує запас їх хімічної енергії.
. Оскільки у більшості випадків температура, за якої компоненти палива використовують у двигуні, дорівнює 293 К або близька до неї, величина повного тепловмісту компонентів палива в основному характеризує запас їх хімічної енергії. ) для стандартних пальних і окислювальних елементів, а також продуктів хімічної реакції, які можуть утворюватися в камері РРД, наведено в табл. 2.2.
) для стандартних пальних і окислювальних елементів, а також продуктів хімічної реакції, які можуть утворюватися в камері РРД, наведено в табл. 2.2.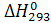 )
)



