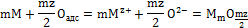Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В каких средах имеет место локальное нарушение пассивности?Стр 1 из 5Следующая ⇒
КОРРОЗИЯ МЕТАЛЛОВ. ОБЩИЕ ПОЛОЖЕНИЯ. В каких средах имеет место локальное нарушение пассивности? В СИЛЬНО ОКИСЛИТЕЛЬНЫХ СРЕДАХ
В чем различие между электрохимической и химической коррозией? В хим корр взаимодействие Ме с корр средой: окисление Ме и восст-е окисл-го комп-та среды протекают в одном акте. А в эл-хим корр нет и скорость процесса зависит от величины электродных потенциалов.
Виды коррозионного разрушения металлов. Сплошная (равномерн, неравномерн, избират) и местная или локальная (пятнами, язвенная, точечная (питтинг), сквозная, межкристаллитная, подповерхностная, ножевая)
4. Вследствие каких причин термодинамически неустойчивые металлы в реальных условиях становятся стойкими против коррозии? Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок Введение в стальной сплав хрома, титана, марганца, никеля и меди позволяет получить легированную сталь с высокими антикоррозийными свойствами. Особенную стойкость стальному сплаву придает большая доля хрома, благодаря которому на поверхности конструкций образуется оксидная пленка большой плотности. Введение в состав низколегированных и углеродистых сталей меди (от 0,2% до 0,5%) позволяет повысить их коррозийную устойчивость в 1,5-2 раза.
Движущая сила процесса электрохимической коррозии. Разность между равновесными потенциалами катодной и анодной реакции.
Для каких целей используется уравнение Нернста? При достижении равновесия значение потенциала Ме становится постоянным, а его величина зависит от внешних условий - Т, Р - и активности ионов Ме в растворе и описывается уравнением Нернста: φМ = φ0м + (R*T/n*F)ln aм n+
Изобразите кривую зависимости коррозионной стойкости железа от скорости движения нейтральной среды. Величина рН растворов оказывает очень незначительное влияние на скорость коррозии, поэтому коррозия Ме в нейтр среде в основном зависит от ее состава.
Как влияет рН раствора на коррозию металлов? Оказывает влияние на перенапряжение водорода - в кислых ср увел рН прив к росту перенапряж водорода, а в щелочн наоборот; влияет на образ и св-ва пленко продуктов корр.
Как влияет температура на скорость коррозии металлов при восстановлении кислорода? Скорость коррозионных процессов, при значительном повышении температуры понижается вследствие уменьшения растворимости кислорода. Повышение температуры иногда приводит к пассивированию металла.
Как перевести металл в пассивное состояние? При смещении потенциала пов-ти Ме в положит сторону на металлич пов-ти образуется оксидн пленка, кот переводит Ме в пассивное состояние.
Как повлияет увеличение перенапряжения водорода на скорость коррозии металла, находящегося в пассивном состоянии? СКОРОСТЬ УМЕНЬШИТСЯ
Какие металлы подвержены водородной коррозии? Как ее предотвратить? Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной коррозии.Медь и медные сплавы подвержены водородной коррозии. Это явление связано с восстановлением закиси меди Cu2О, которая входит в виде включений в состав многих медных сплавов: Cu2О + Н2 = Н2О + 2Cu Образующиеся пары воды создают внутри металла высокое давление, что приводит к возникновению трещин и потере пластичности. Мерой борьбы против этого явления является снижение содержания закиси меди в сплавах. При концентрации Cu2О не более 0,01 % явления водородной коррозии не наблюдается.
13. Какие сопротивления оказывают существенное влияние на кинетику электрохимической коррозии? · Сопротивление реакции перехода, · Сопротивление процессов, связанных с конвекцией, · Диффузионное сопротивление.
Какими приемами можно сместить потенциал металла в положительную сторону? Большое влияние на величину потенц оказывают окислители, находящиеся в электролите, под действием которых на пов-ти Ме может образоваться защитная пленка, что приводит к смещению потенциала в положит сторону.
Какова роль окислителей при переходе металла в оксидное состояние? При переходе металлов в оксидное состояние образуются продукты коррозии в виде пленок:
Наличие пленок на поверхности металла в зависимости от их защитных свойств может в той или иной степени тормозить процесс газовой коррозии.
Уравнение Нернста. В каких случаях оно применимо? φМ = φ0м + (R*T/n*F)ln aм n+, а = f*C - активность ионов Ме, f-коэф-т активности, С-конц-я. Уравнение применимо для равновесных процессов.
Уравнение Тафеля. η = a+b*lg ik η-перенапряжение водорода, а-пост, зависящая от материала катода, состояния его пов-ти, состава раствора и температуры, b-постоянная, завис от темпер и природы затрудненной стадии катодной реакции, ik - плотность тока на катоде.
Правило Таммана. Резкое повышение устойчивости к коррозии железа наблюдается при введении легир-ей добавки в кол-ве 1/8 атомной доли, то есть один атом легир-ей добавки приходится на восемь атомов железа. Считается, что при таком соотношении атомов происходит их упорядоченное расположение в кристаллической решетке твердого раствора, что и затрудняет коррозию.
Что такое ток обмена? Ток обмена - плотность тока обмена - осн параметр электрохимической кинетики, характеризующий равные по величине скорости катодного и анодного процессов при равновесном электродном потенциале φр; обозначается i0.
ЗАЩИТА МЕТАЛЛОВ И СПЛАВОВ. Протекторная защита является разновидностью катодной защиты. К защищаемой конструкции присоединяют более электроотрицательный металл — протектор(магниевый,цинковый,алюминевый) — который, растворяясь в окружающей среде, защищает от разрушения основную конструкцию. Преимущество протекторной защиты состоит в том, что нет надобности во внешнем источнике постоянного тока.
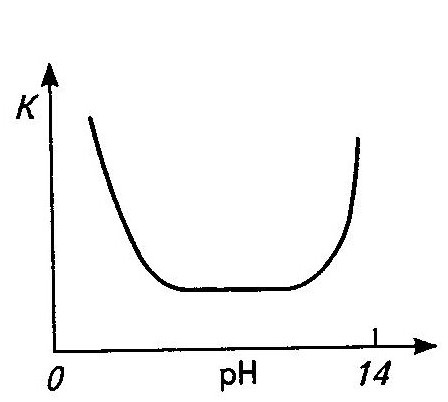
КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ 69. Графическая зависимость скорости коррозии бронзы от рН среды. Бронзы-сплав меди с оловом, Al, Si, Mn, Pb, Fe.
Т.е. неустойчивы и в кислых и в щелочных средах, что связано с амфотерными св-ми их защитных пленок, способных растворяться и в кислых и в щелочных средах.
Состав сплавов типа нихром. Нихром — общее название группы сплавов, состоящих, в зависимости от марки сплава, из 55—78 % никеля, 15—23 % хрома, с добавками марганца, кремния, железа, алюминия. Х18Н10, Х18Н10Т,12Х18Н10Т- различное содержание углерода. Эти стали устойчивы в растворах азотной, серной кислот, в фосфорной в конц-ии до 60%. 08Х17Н13МТ, 10Х17Н13М2Т, 03Х17Н14М3, 08Х17Н15М3Т- стали, легированные молибденом. Эти стали моно сваривать. 02Х8Н22С6- добавление кремния (С). Кремний для работы в неокислительных средах при повышенных температурах.
Химическая стойкость хрома. Хром стоек в природных водах, растворах солей и слабых органических кислот при наличии растворенного кислорода, в окислительных кислотах (азотной, хромовой). В восстановительных средах(серная, соляная кислоты). Хром устойчив лишь в не очень концентрированных щелочах при нормальной температуре. В более жестких условиях образуются растворимые хромиты и металл становится нестойким. Хром обладает высокой стойкостью в окислительных газовых средах при повышенных температурах, а также в атмосферных условиях, в том числе при наличии примесей сероводорода, диоксидов серы и углерода.
Примеры химически стойких лакокрасочных покрытий. Битумные и каменноугольные лаки и краски, обладающие химической стойкостью в слабо агрессивных средах; лаки и эмали на основе перхлорвиниловой смолы; лаки на основе фенолформальдегидной смолы стойки в растворах минеральных кислот, солей и органических растворителей; лаки и эмали на основе эпоксидных смол кислото- и щелочестойкие.
Требования к лакокрасочным покрытиям. Лакокрасочный материал должен обладать комплексов св-в, обеспечивающих получение прочной, беспористой пленки, оптимальной вязкостью.
Химическая стойкость резин. Используются в качестве защитных покрытий в виде гумирования. Имеют низкую масло- и бензостойкость, неустойчивы в HNO3.
КОРРОЗИЯ МЕТАЛЛОВ. ОБЩИЕ ПОЛОЖЕНИЯ. В каких средах имеет место локальное нарушение пассивности? В СИЛЬНО ОКИСЛИТЕЛЬНЫХ СРЕДАХ
|
|||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 343; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.118.95 (0.013 с.) |