Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Агрегатні стани і фазові переходи.Содержание книги
Поиск на нашем сайте
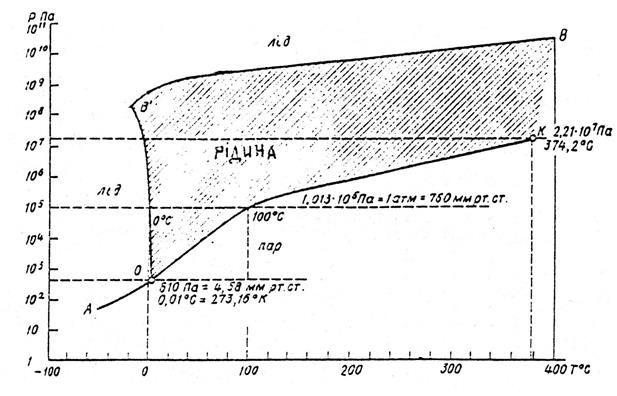
Залежність агрегатного стану води від тиску і температури зображена на діаграмі стану води, або фазовій діаграмі (рис.1.1). Крива ВВО називається кривою плавлення. При переході через неї зліва направо відбувається плавлення льоду, а зправа наліво – льодоутворення (кристалізація води). Крива ОК - крива пароутворення. При переході через неї зліва направо відбувається кипіння води, а справа наліво-конденсація водяної пари. АО - крива сублімації. При перетині її зліва направо відбувається випаровування льоду, а справа наліво - конденсація в тверду фазу (сублімація). Точка О називається потрійною точкою. В ній при тиску 610 Па і температурі 0,01 0С (273,16 0К) вода одночасно є у всіх трьох агрегатних станах. Температура замерзання води Тзам і температура кипіння води Ткип залежить від тиску Р. В діапазоні зміни тиску від 610 до 1,013·105 Па (чи 1 атм.) Тзам трохи знижується (від 0,01 до 0 0С), потім при рості тиску приблизно до 6·107 Па (600 атм.) Тзам падає до –5 0С, а при збільшенні Р до 2,2·108 Па (2 200 атм.) Тзам зменшується до –22 0С. При подальшому збільшенні тиску Тзам починає швидко зростати. При дуже великому тиску утворюються особливі модифікації льоду, що відрізняються своїми властивостями від звичайного льоду. Температура кипіння зі зменшенням тиску знижується. Тому на великих висотах в горах вода кипить при температурі нижчій, ніж 100 0С. При рості тиску Ткип зростає до т.зв. "критичної" точки К, коли при Р=2,2·107 Па і Т = 374 0С вода має одночасно властивості і рідини і газу. На Тзам води впливає її солоність S[‰]. Солоність – це відношення маси солі до маси розчину, виражене в промілле:
Збільшення солоності знижує Тзам: Тзам = - 0,054 S [0С], де (1.2) S – солоність води в ‰. Густина води та її зміна в залежності від температури. Густина ρ [кг/м3] - маса речовини в одиниці об’єму. Для всіх рідин, крім води, вона зростає при зниженні температури аж до точки замерзання. У прісної ж води при нормальному тиску ρ зростає зі зниженням температури лише до 3,98 0С ≈ 4 0C, а при подальшому охолодженні густина зменшується аж до точки замерзання 0 0С (табл.1.1).Отже температура 4 0С є для прісної води температурою найбільшої густини (Тнг). Густина льоду значно менша, ніж води в рідкому стані.
Таблиця 1.1 Густина води і льоду при різній температурі, кг/м3
Рис. 1.1 Діаграма фазового стану води
Рис. 1.2. Залежність температури замерзання (1) та температури найбільшої густини (2) від солоності (графік Хелланд-Хансена).
Ця унікальна властивість води має надзвичайно велике значення для життя на Землі: водойми достатньої глибини взимку не промерзають до дна, бо охолоджена нижче 4 0С вода, як менш важка, займає верхні шари водойми, на поверхні при мінусових температурах повітря вона може замерзнути, утворивши льодову кірку певної товщини. Але біля дна розташується найбільш важка вода при температурі 4 0С і залишатиметься рідкою. Крім того лід плаває по поверхні води, і, як відносно поганий провідник тепла, перешкоджає значному зниженню температури води на глибині. Все це дозволяє перезимувати водним організмам. Густина води збільшується з ростом її солоності. Одночасно збільшення солоності води веде до зниження температури найбільшої густини (при якій вода найважча) згідно з формулою: Тнг = 4 - 0,215 S [0C], де (1.3) S - солоність води в ‰. Залежність температури найбільшої густини (Тнг) і температури замерзання (Тзам) від солоності ілюструє графік Хеланд-Хансена (рис.1.2). З нього видно, що унікальна властивість води (Тнг > Тзам ) проявляється лише при солоності, меншій за 24,7‰. Теплові властивості води. В порівнянні з іншими рідинами питома теплота плавлення льоду і питома теплота пароутворення води аномально високі. Питома теплота плавлення льоду Lл =333 333 (Дж/кг). Стільки ж теплоти виділяється при замерзанні (кристалізації) води. Питома теплота пароутворення Lпар залежить від температури: Lпар = 2,5·106 - 2,4·103 T 0C (Дж/т) (1.4) Для нагрівання води поза точками фазових переходів необхідно затратити велику кількість тепла, бо питома пеплоємність води (Ср) також "аномально" висока в порівнянні з теплоємністю інших рідин і твердих речовин: Ср =4190 (Дж/кг 0С). Дуже високі питома теплота плавлення (замерзання) і випаровування (конденсації), а також велика теплоємність води мають величезний вплив на теплові процеси не тільки в водних об’єктах, але й на всій планеті.
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 820; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.199.240 (0.007 с.) |

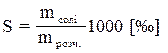 (1.1)
(1.1)