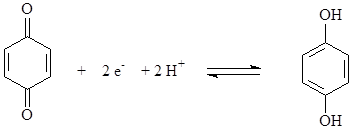Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изучение влияния лигандного окружения на редокс-потенциал
Цель. Изучить зависимость редокс-потенциала от лигандного окружения центрального атома. Закрепить навыки потенциометрических измерений. Задание: Определить величины редокс-потенциала системы железа (Ш)/ железа (П) в присутствии гидрофосфат- и цианид-ионов. Оборудование и реактивы: Иономер ЭВ-74, электроды платиновый и хлорсеребряный; химические стаканы, бюретка. Водные р-ры гексацианоферрата (Ш) калия, гексацианоферрата(П) калия, хлорида калия, дигидрофосфата натрия, гидрофосфата натрия, хлорида железа и соль Мора (с=0,01 моль/л).Термометр. Сущность работы: Для определения редокс-потенциалов собирают гальваническую цепь, состоящую из редокс-электрода и хлорсеребряного электрода. По измеренным величинам ЭДС рассчитываеют величины редокс-потенциалов. Для выявления зависимости φr от лигандного окружения измеряют редокс-потенциал для систем, имеющих один и тот же центральный атом(железо), одинаковое соотношение концентраций окисленной и восстановленной форм, но отличающихся лигандным окружением(вода, гидрофосфат-ион, цианид-ион). Если константа устойчивости комплекса с восстановленной формой больше аналогичной величины для окисленной формы, то значение редокс-потенциала увеличится. Если константа устойчивости комплекса с окисленной формой больше аналогичной величины для восстановленной формы, то значение редокс-потенциала уменьшится. Выполнение эксперимента: 1.Готовят иономер ЭВ-74 к работе. 2. Готовят растворы, содержащие изучаемые редокс-системы. 3.Измеряют ЭДС гальванической цепи. Схема гальванической цепи: 1.Ag, AgCl │KCl║K3[Fe(CN)6], K4[Fe(CN)6] │ Pt 2. Ag, AgCl │KCl║[Fe(H2O)6]3+ / [Fe(H2O)6]2+│ Pt 3. Ag, AgCl │KCl║[Fe(HPO4)(H2O)4]+ / [Fe(HPO4)(H2O)4]│ Pt
4. Рассчитывают величину редокс-потенциала. Найденные значения записывают в таблицу:
Расчёты: *В выводе отмечают выявленную зависимость. теоретически обосновывают, используя значения констант нестойкости цианидных и гидрофосфатных комплексов с окисленной и восстановленной формой изучаемой редокс-системы. Сравнивают полученное значение φr° Fe3+/Fe2+ с теоретическим(табличным).
Вывод: Дата ___________ Занятие __________ Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии». 8.106; 8.111; 8.113;8.115 Дата ________ Лабораторная работа 6.11 Изучение влияния рН на редокс-потенциал. Цель: Изучить зависимость редокс-потенциала от рН среды. Задание: Изучить зависимость редокс-потенциала от рН среды на примере системы хинон-гидрохинон; определить значениие стандартного и формального редокс-потенциала для этой системы. Оборудование и реактивы: Иономер ЭВ-74, электроды платиновый и хлорсеребряный, химический стакан вместимостью 25 мл, стеклянная палочка. Термометр. Раствор хин-гидрон насыщенный в этаноле. Сущность работы: При растворении в воде хингидрона (соединение n-бензохинона и гидрохинона) быстро устанавливается равновесие
хинон гидрохинон
Увеличение в растворе концентрации ионов водорода приводит к смещению равновесия влево, а ее уменьшение – вправо. Т.О, изменение рН раствора приводит к изменению концентраций окисленной и восстановленной форм, т.е. к изменению редокс-потенциала. Выполнение эксперимента: 1. Готовят иономер ЭВ-74 к работе. 2. Готовят растворы, содержащие изучаемые редокс-системы. 3. Измеряют ЭДС гальванической цепи. Схема гальванической цепи: Ag, AgCl │KCl║хинон, гидрохинон │ Pt 4. Рассчитывают величину редокс-потенциала. Найденные значения записывают в таблицу:
Обработка результатов эксперимента: Значения редокс-потенциалов рассчитывают по уравнению: φr = Е + φ срав Строят график зависимости φr = f (рН)
*В выводах отмечают зависимость редокс-потенциала системы от рН и приводят определенные графическим способом значения стандартного и формального редокс-потенциала системы хинон-гидрохинон. Вывод: Дата ________
Лабораторная работа 8.3 Измерение рН растворов с помощью стеклянного электрода Цель: Научиться определять рН водных растворов потенциометрическим методом. Задание: Определить рН двух растворов, предложенных преподавателем. Оборудование и реактивы: Иономер ЭВ-74, электроды стеклянный и хлорсеребряный, химический стакан. Буферные растворы с известными значениями рН, исследуемые растворы с неизвестными значениями рН.
Сущность работы: Для определения рН р-ра составляют гальваническую цепь, состоящую из стеклянного и хлорсеребряного электродов, проводят калибровку электрода с использованием буферных р-ров, имеющих известное значение рН. Выполнение эксперимента: 1.Готовят иономер ЭВ-74 к работе. 2. Калибруют стеклянный электрод. 3.Измеряют рН исследуемого раствора.
Схема гальванической цепи: Ag, AgCl │с(НCl)= ¦ стекло│ исследуемый раствор║с(КCl)= │ AgCl,Ag
Результаты: значение рН исследуемого раствора № равен.
Ошибка эксперимента составляет:
* В выводе указывают полученный результат и метод исследования. Вывод: Лабораторная работа 9.3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 248; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.103.209 (0.006 с.) |