Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Повреждение оснований ДНК химическими мутагенами
Азотистые основания могут алкироваться, окисляться, восстанавливаться или связываться с формамидными группировками. Репарация происходит с присоединения ДНК-N-гликозилазы к поврежденному основанию. Существует множество гликозилаз, специфичных к разным модифицированным основаниям. Ферменты расщепляют N-гликозидную связь, способствуют образованию АП-сайта, дальше работают ДНК-инсертазы, АП-эндо- и экзо-нуклеазы, ДНК-полимераза β и ДНК-лигазы.
Дефекты репарационных систем и наследственные болезни Снижение активности ферментов репарационных систем приводит к накоплению повреждений (мутаций в ДНК). Причиной многих наследственных болезней является нарушение отдельных этапов процесса репарации. (пигментная ксеродерма, триходиодистрофия).
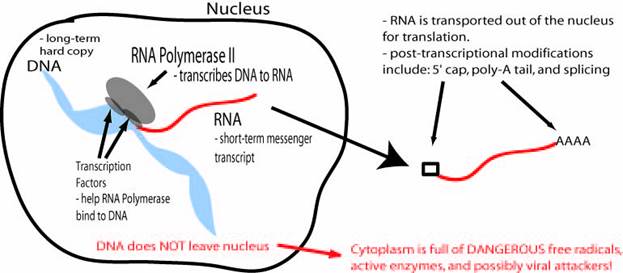
Транскрипция Первая стадия реализации генетической информации в клетке. Образуются молекулы мРНК, которые служат матрицей для синтеза белка, а также тРНК, рРНК и другие виды молекул РНК. В основе транскрипции лежит также принцип комплементарности оснований в молекуле РНК: G≡C, A=U, T=A. ДНК служит только матрицей и в ходе транскрипции не меняется. ЦТФ, ГТФ, АТФ, УТФ являются субстратами и источниками энергии. Синтез молекул РНК начинаются в определенных сайтах ДНК(промоторы) и завершается в терминирующих участках (сайты терминации). Участок ими ограниченный – транскриптон. В состав транскриптона обычно входит один ген. В каждом транскриптоне присутствует неинформативная зона. Она содержит нуклеотиды для взаимодействия с регуляторными транскрипционными факторами. Транскрипционные факторы – это белки, замедляющие или ускоряющие трпнскрипцию. Соседние транскриптоны могут отделяться друг от друга нетранскрибируемыми участками ДНК. Разделение ДНК на множество транскриптонов позволяет считывать разные гены с разной скоростью. В каждом транскриптоне транскрибируется только одна из цепей ДНК, которая называется матричной, вторая комплементарная ей – кодирующая. Матричная цепь всегда антирараллельна синтезируемой цепи. Синтез идет от от 5’- k 3’- концу. Транскрипция не связана с фазами клеточного цикла и зависит от потребностей клетки. Биосинтез РНк осуществляется ДНК-зависимыми РНК-полимеразами. Их три. РНК-полимераза I синтезирует пре-рРНК. РНК-полимераза II синтезирует пре-мРНК. РНК-полимераза III синтезирует пре-тРНК. Это олигомерные белки, состоящие из нескольких субъединиц - 2α, β, β’, σ.
Субъединица σ выполняет регуляторную функцию.
Стадии транскрипции Различают 3 стадии: инициация, элонгация и терминация. Инициация. Активация промотора происходит с помощью белка – ТАТА- фактора. Он взаимодействует со специфической последовательностью нуклеотидов – ТАТААА-(ТАТА-бокс). Присоединение ТАТА-фактора облегчает взаимодействие промотора с РНК-полимеразой. Раскручивается один виток спирали ДНК, т.е. образуется транскрипционная вилка и матрица становится доступной для инициации синтеза цепи РНК. Синтезируется нуклеотид из 8-10 остатков, σ-субъединица отделяется от РНК-полимеразы и на ее место присоединяются факторы элонгации. Элогнация. Факторы элонгации повышают активность РНК-полимеразы и облегчают расхождение цепей ДНК. Синтез идет от от 5’- k 3’- концу комплементарно матричной цепи ДНК. На этой стадии в области транскрипционной вилки одновременно разделены примерно 18 нуклеотидных пар ДНК. Растущий конец цепи РНК образует временную гибридную спираль из ≈ 12 пар нуклеотидных остатков ДНК. По мере продвижения РНК-полимеразы по матрице в направлении от 3’- k 5’- концу впереди происходит расхождение, а позади восстановление двойной цепи ДНК.
Терминация. Завершается синтез РНК в сайтах-иерминации. Фактор терминации облегчает отделение первичного транскрипта (пре-м-РНК), комплементарного матрице, и РНК-полимеразы от матрицы. РНК-полимераза может вступать в следующий цикл транскрипции после присоединения суъединицы σ. Процессинг матричной РНК. Первичные транскрипты продвергаются модификации. Это необходимо для функционирования мРНК в качестве матрицы. Модификация начинается, когда длина первичного транскрипта достигает примерно 30 нуклеотидов. На 5’-конце происходит кэпирование. Гуанилилтрансфераза гидролизует макроэргическую связь в ГТФ и присоединяет нуклеотиддифосфатный остаток 5’-фосфатной группой к 5’-концу синтезированного фрагмента РНК с образованием 5’, 5’-фосфодиэфирной связи. Далее метилирование остатка гуанина в составе ГТФ с образованием N7-метилгуанозина и этим завершается образование кэпа.
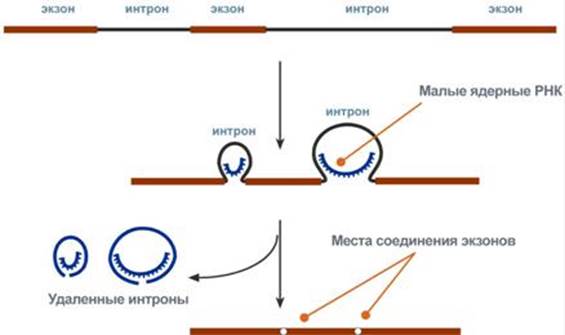
Модифицированный 5’-конец обеспечивает инициацию трансляции, удлиняет время жизни мРНК, защищая ее от действия экзонуклеаз в цитоплазме. Кэпирование необходимо для инициации синтеза белка, т.к. инициирующие триплеты AUG и GUG распознаются рибосомой только в присутствии в присутствии кэпа. Наличие кэпы необходимо для обеспечения ферментного удаления интронов. Модификация 3’-конца происходит под действием полиА-полимеразы. Формируется полиА-последовательность (полиА-хвост) из 100-200 остатков адениловой кислоты. Сигналом к началу полиаденирования является последовательность – ААUААА- на растущей цепи РНК. Наличие полиА-хвоста облегчает выход мРНК из ядра и замедляет ее гидролиз в цитоплазме. Сплайсинг мРНК происходит в ядре и в цитоплазму поступает уже зрелая РНК с вырезанными интронами. Процесс вырезания интронов происходит при участии малых ядерных рибонуклеопротеинов (мяРНП). В их состав входят мяРНК. На 5’- и 3’-концах имеются специфические последовательности AGGU и GАGG, которые и обеспечивают удаление интронов из пре-мРНК.
Существует альтернативный сплайсинг, который приводит к формированию разных мРНК и соответственно к синтезу белков тканеспецифичных или к изоформам различных белков. Это происходит потому, что интроны в одном положении могут быть экзонами с соответствующими последствиями.
|
||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 171; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.77.71 (0.006 с.) |