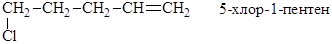Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ненасыщенные галогенпроизводные
Ненасыщенные галогенпроизводные в зависимости от удаления атома галогена от кратной связи делят на три группы: а) атом галогена находится при атоме углерода с кратной связью (СН2=СН-Cl) – винилгалогенид. б) галоген удален от кратной связи на одну метиленовую группу (СН2=СН-СН2-Cl) – аллилгалогенид. в) галоген удален более чем на одну метиленовую группу (СН2=СН-(СН2)2-Cl) а) Хлористый винил СН2=СН-Cl можно получить в результате следующих химических превращений:
Рассмотрим химические свойства этих соединений в двух аспектах: а) влияние двойной связи на реакционную способность галогена, б) влияние галогена на реакционную способность двойной связи. Галогенпроизводные группы а) отличаются малой подвижностью галогена, что объясняется эффектом сопряжения неподеленной пары электронов галогена с электронами кратной связи, приводящее к изменению кратности связи (больше 1) С-Cl, увеличению энергии связи и уменьшению ее длины.
Данные по дипольным моментам и длинам связей (табл. 4) подтверждают это рассуждение Таблица 13.1 Дипольные моменты, энергии и длины связей хлорэтана и хлорэтилена
Обычные реакции нуклеофильного замещения, характерные для алкилгалогенидов, невозможны для хлористого винила и подобных ему соединений.
С другой стороны, атом галогена в значительной степени снижает электронную плотность С=С, благодаря своему отрицательному индукционному эффекту, и реакции электрофильного присоединения по С=С связи затрудняются. Присоединение происходит в соответствии с правилом Марковникова:
Реакция присоединения протекает через стадию образования более стабильного катиона (1).
б) Галоген находится в a-положении по отношению к кратной связи:
Хлористый аллил получают в промышленности высокотемпературным хлорированием пропилена:
Для галогена этой группы соединений характерна максимальная реакционная способность (подвижность) в реакциях замещения. Это связано со способностью аллилгалогенидов к диссоциации
Способность к диссоциации объясняется большой устойчивостью образующегося карбониевого катиона по сравнению с алкильным карбониевым катионом:
В этом случае p-электроны С=С связи в большей степени гасят положительный заряд, чем положительный индукционный эффект алкильной группы и эффект сверхсопряжения в алкилгалогенидах. Реакция замещения атома хлора в аллилгалогенидах протекает по механизмам SN1, в этом случае возможна перегруппировка.
в) Галоген удален от двойной связи двумя и более С-С связями
В этом случае свойства галогена аналогичны свойствам галогена в галоидных алкилах, а свойства двойной связи аналогичны свойствам кратной связи в алкенах. АРОМАТИЧЕСКИЕ ГАЛОГЕНПРОИЗВОДНЫЕ Делятся на две группы: 1. Соединения, содержащие галоген в боковой цепи:
2. Соединения, содержащие галоген в ароматическом ядре:
Способы получения ароматических галогенпроизводных С галогеном в ядре Галогенирование Хлор- и бромпроизводные бензола получают реакцией галогенирования в присутствии кислот Льюиса (электрофильное ароматическое замещение SE, см. ч.1, лекция №10)
Иодпроизводные получить таким образом невозможно, так как реакция обратима. Реакцию обычно проводят в присутствии окислителя. Присутствие окислителя (например, HNO3) необходимо, т.к. он окисляет НI до иодноватистой кислоты и способствует протеканию реакции в прямом направлении.
2. Из солей диазония.
Способы получения ароматических галогенпроизводных С галогеном в боковой цепи Для получения таких соединений пригодны все методы получения алкилгалогенидов. Прямое галогенирование Наиболее распространенным является способ прямого галогенирования. Реакция протекает по радикальному механизму:
Можно ввести второй и третий атомы галогена. При этом образуются ди- и тризамещенные производные:
Хлорметилирование Реакция хлорметилирования в присутствии кислот Льюиса (AlCl3, ZnCl2) - электрофильное замещение.
Параформ - полимер формальдегида, при пропускании HCl деполимеризуется, образуя хлорметильный катион +СН2Сl, реагирующий с ароматическим кольцом. Практически хлорметилирование целесообразнее, чем алкилирование, с последующим галогенированием, так как при хлорметилировании образуется один продукт, а галогенирование алкилпроизводных бензола дает смесь галогенидов. Физические свойства Галогенпроизводные бензола и его гомологов – жидкости или кристаллические вещества. Из полихлорпроизводных бензола кристаллическим является п -дихлорбензол (т. пл. 53ºС). Плотность галогенпроизводных бензола больше 1. температура кипения повышается от фторпроизводных к йодпроизводным. Соединения с галогеном в ядре имеют «ароматический» запах. Соединения с галогеном в боковой цепи в α-положении к ядру обладают раздражающим действием (лакриматоры). В воде все соединения этого ряда нерастворимы, растворяются в большинстве органических растворителей. Химические свойства Рассмотрим галогенпроизводные с галогеном в ядре. В обычном понимании галогенпроизводные такого типа неактивны, также как и галогенпроизводные типа CH2=CH-Cl. 1) Реакции нуклеофильного замещения, характерные для алкилгалогенидов, нехарактерны для арилгалогенидов. Инертность галогенпроизводных в реакциях нуклеофильного замещения объясняется наличием сопряжения неподеленных электронных пар галогена с p-сопряженной системой бензольного кольца, что приводит к уменьшению частичного положительного заряда атоме углерода бензольного кольца
Реакции нуклеофильного замещения протекают в более жестких условиях
Предполагают, что реакция в этом случае протекает через стадию дегидрирования с образованием дегидробензола и последующим присоединением
Способность к реакциям нуклеофильного замещения возрастает, если в орто- и пара- положениях к галогену находится сильная электроноакцепторная группа. Это обусловлено тем, что на атоме С, связанным с атомом галогена, увеличивается положительный заряд, и атом углерода легко взаимодействует с нуклеофильными агентами с вытеснением атома галогена:
2) Галоген в ядре дезактивирует бензольное кольцо в реакциях электрофильного замещения и направляет электрофильный агент в орто- и пара-положения.
3) Арилгалогениды легко образуют реактив Гриньяра:
Фенилмагнийбромид - очень реакционноспособное вещество. Группа MgBr легко замещается на другие группировки. 4) Легко получаются и литийпроизводные бензола:
Отдельные представители В технике из галогеналканов наибольшее применение имеют хлористый метил и хлористый этил. В химической промышленности их применяют как алкилирующие средства. Хлористый этил применяется в больших количествах для получения антидетонатора тетраэтилсвинца (ТЭС), а также в медицине для кратковременного наркоза и для местной анестезии (обезболивания), в частности, в зубоврачебной практике. Из галогенпроизводных непредельных углеводородов наибольшее техническое значение имеют хлористый винил, хлористый аллил, тетрафторэтилен, хлоропрен. Полимеры хлористого винила широко применяются в производстве изоляционных материалов и других изделий. Хлоропрен применяется для получения синтетического каучука, устойчивого к истиранию, огню, плохо пропускающего газы. Тетрафторэтилен полимеризуется с образованием продукта, известного под названием тефлон. Из тефлона, благодаря его исключительной химической и биологической инертности, изготовляют стойкие к действию агрессивных сред детали аппаратуры, а также искусственные кровеносные сосуды. В ряду ароматических галогенпроизводных углеводородов наибольшее значение имеют хлорбензол, п-дихлорбензол, хлористый бензил. Хлорбензол применяется в химической промышленности в качестве промежуточного продукта в производстве анилина, фенола, инсектицидов. п- Дихлорбензол используют в качестве «лярвицида» (средство, убивающее личинок насекомых – вредителей сельскохозяйственных культур) и средства против моли. Хлористый бензил является промежуточным продуктом в производстве бензилового спирта – важного полупродукта парфюмерной промышленности.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 258; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.184.195 (0.006 с.) |