
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Валентные возможности атомовСодержание книги Поиск на нашем сайте
Для ответа по п.4 задания I части необходимо из рекомендованного вам «Опорного конспекта лекций по химии» (или из других учебников по химии для высшей школы) выучить раздел «Энергетическое состояние электрона в атоме» (стр. 48-50). Особое значение здесь будет играть схема относительного расположения орбиталей для многоэлектронных атомов (рис. 6(б), стр. 48). Для начала необходимо: - написать электронную формулу атома хлора: 1s22s22p63s23p5; - выделить внешние электроны: 3s23p5;
Для дальнейшего ответа необходимо знать основные представления по химической связи («Опорный конспект по химии», стр. 59-63), в том числе: - основное и возбужденное состояние электронов в атоме (стр. 49); - обменный механизм образования ковалентной химической связи (стр. 62); - донорно-акцепторный механизм образования ковалентной химической связи (стр. 62). Примечание. При рассмотрении валентных возможностей атомов следует учитывать указанные возможности по образованию прежде всего ковалентного типа связи (неполярной и полярной). К тому же следует понимать, что валентные возможности и конкретная валентность (ковалентность) - разные понятия. Валентные возможности – это теоретическая «максимальная» валентность, которая, как правило, всегда меньше валентности конкретных атомов элементов в реально существующих соединениях. При этом, численная величина валентных возможностей, как и численная величина валентности, знака не имеет. При определении валентных возможностей необходимо найти максимально возможные значения валентных возможностей того или иного атома, а также их количество по обменному и донорно-акцепторному механизмам образования ковалетной химической связи. Определение валентных возможностей корректно проводить для атомов неметаллов или полуметаллов, которые могут образовывать химические соединения с ковалентным типом (характером) химической связи. Для определения валентных возможностей атома хлора в нормальном состоянии необходимо: - сосчитать количество свободных внешних электронов и количество электронных пар или количество свободных атомных ячеек на последнем задействованном энергетическом подуровне. (Задействованным подуровнем считается такой, на котором в нормальном (невозбужденном) состоянии имеется хотя бы один электрон). В нашем случае количество неспаренных электронов у атома хлора в нормальном состоянии равно 1. - сосчитать количество электронных пар на внешних подуровнях. В нашем случае их 3 – одна на подуровне 3s и две на подуровне 3p. Таким образом, валентные возможности (В.в.) атома хлора в нормальном состоянии равны 4: В.в. (Cl) = 1обм + 3дд.а., в том числе одна по обменному механизму (обм), три – по донорно-акцепторному (д.а.), где атом хлора выступает в качестве донора (д.), т.е. атома, предоставляющего при образовании ковалентной химической связи электронную пару. Формальная схема реализации таких возможностей представлена ниже:
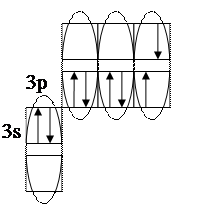
Для определения валентных возможностей атома хлора в возбужденном состоянии необходимо: - построить для атома хлора графическую электронную формулу (2-й вариант) с учетом ближайшего незаполненного энергетического подуровня. В нашем случае – это 3d-подуровень (рис. 6, стр. 48. «Опорный конспект лекций по химии»).
Отметим, что при возбуждении электронов, т.е. переводе их на более высокий энергетический подуровень того же энергетического уровня, определяемого значением главного квантового числа n (в нашем случае n=3), энергетические затраты (Ев) не столь значительные и могут быть скомпенсированы при образовании химической связи (Ехс). При переходе электрона с энергетического подуровня одного электронного слоя на энергетический подуровень другого электронного слоя, энергетические затраты (Е1в) оказываются больше, чем выигрыш энергии при образовании химической связи, т.е. такая валентная возможность не может быть даже формально реализована ни в каких химических соединениях. Поэтому такие валентные возможности не учитываются. Вышесказанное поясняют схемы, приведенные ниже.
Образование химической связи энергетически возможно. Таким образом, в нашем случае распределение электронов для атома хлора в возбужденном состоянии будет выглядеть следующим образом:
Исходя из данной графической формулы, валентные возможности атома хлора в возбужденном состоянии (Cl*) равны 9: В.в. (Cl*) = 7обм + 2ад.а., в том числе семь по обменному механизму (обм), две – по донорно-акцепторному в качестве акцептора (а), т.е. атома предоставляющего свободные атомные ячейки на задействованном энергетическом уровне. Формальная схема гипотетической реализации таких возможностей представлена ниже:
Еще раз подчеркнем, что такие максимальные валентные возможности, как правило, не могут быть реализованы в реальных химических соединениях, в частности из-за геометрических размеров атомов. 2.2. II часть контрольного задания Пусть ваше задание по II части сформулировано следующим образом: «Написать (последовательно) химические процессы, происходящие при контакте алюминия с раствором сульфида лития. Обосновать возможность их протекания». а) Сначала рассмотрим металл. В нашем случае это алюминий. Какой это металл по активности? Из школьного курса вы знаете, что Al, также как щелочные и щелочноземельные металлы, относятся к активным металлам. А это значит, что он на воздухе обязательно будет реагировать с кислородом воздуха, т.е. будет покрыт оксидной пленкой Al2O3. Таким образом, при рассмотрении процессов, происходящих в нашей системе, необходимо учитывать наличие не только самого металла, но и его оксидной пленки. Следовательно, прежде чем рассматривать реакции с участием алюминия, необходимо рассмотреть реакции с участием его оксида. Для этого следует определить его свойства. Из «Опорного конспекта лекций по химии», стр. 23, вы узнаете, что оксид алюминия обладает амфотерными свойствами.
В результате по рассматриваемому заданию у нас есть следующая информация: – активный металл Al; – на этом металле имеется оксидная пленка Al2O3; – оксид алюминия обладает амфотерными свойствами, т.е. способен реагировать либо с сильными основаниями (щелочами), либо с сильными кислотами. б) Далее рассмотрим раствор соли. В нашем случае это сульфид лития и вода: Li2S + H2О. Что это за соль? Данная соль, образована сильным основанием (LiOH) и слабой кислотой (H2S). А такие соли в воде подвергаются гидролизу («Опорный конспект лекций по химии», стр. 131-134):
В случае таких солей, также как и в случае солей, образованных слабым основанием и сильной кислотой, гидролиз практические идет только по первой ступени. Кроме того, не будем забывать, что гидролиз во многих случаях, и в нашем тоже, является обратимым процессом. Об этом свидетельствуют противоположно направленные стрелки. Давайте запишем процесс гидролиза в ионном виде. В отличие от записи реакции в молекулярной форме (см. ранее), такая запись реакции дает нам возможность более наглядно определить характер среды, образующейся в результате гидролиза (иногда говорят «определить реакцию среды»). В нашем случае запись реакции в ионном виде (ионной форме) запишется так:
S2- + H2O HS- + OH- Примечание. Для правильной записи реакции в ионном виде следует вспомнить, что малодиссоциирующие соединения (в нашем случае H2O), а также слабые кислоты, слабые основания и их остатки (в нашем случае HS-) на ионы не раскладываются. Из записи реакции в ионном виде наглядно видно, что в результате гидролиза соли Li2S в продуктах реакции наблюдается появление гидроксид–ионов OH-, т.е. среда становится щелочной. Используя водородный показатель можно записать, что в нашем случае pH>7. в) Далее нам следует рассмотреть: как будет вести себя оксидированный с поверхности алюминий, когда он будет находиться в контакте с частично гидролизованным сульфидом лития в щелочной среде. Зная, что амфотерные оксиды взаимодействуют с сильными основаниями (а LiOH – одно из них) образуя соль и воду, запишем:
Таким образом, оксидная пленка может раствориться. С чем теперь может взаимодействовать Al? Кислоты нет, по сравнению с Li он менее активен (см. ряд активности, «Опорный конспект лекций по химии», стр. 140), т.е. не может вытеснить литий из его солей. Остается вода. Из школьного курса химии мы знаем, что активные металлы способны вытеснять водород из воды:
Давайте докажем, что в нашем случае, т.е. в условиях щелочной среды, такая окислительно-восстановительная реакция действительно будет происходить. (Об окислительно-восстановительных реакциях см. «Опорный конспект лекций по химии», стр. 135-141). Для этого запишем для этой реакции процессы окисления и восстановления:  Al – 3ē = Al+3, процесс окисления; Al – 3ē = Al+3, процесс окисления;
Затем, возьмем численные данные по стандартным окислительно-восстановительным потенциалам (Е0 или φ0), характеризующие указанные процессы. Эти данные есть во многих учебниках или учебных пособиях по химии (см. также «Опорный конспект лекций по химии», стр. 159). Для алюминия это потенциал Ео равен -1,66 (В), для водорода в щелочной среде потенциал Ео равен -0,83 (В). Данное значение Ео для водорода получаем, используя уравнение Нернста («Опорный конспект лекций по химии», стр. 141). Поскольку LiOH – сильное основание (щелочь), то значение рН будет не просто больше 7, а значительно больше, поскольку в результате гидролиза Li2S среда будет сильнощелочной, рН = 10
Реакция способная протекать самопроизвольно, если разность потенциалов ΔЕ, характеризующих процесс восстановления и окисления (ЭДС реакции), будет больше нуля. В нашем случае: DЕ = -0,83 – (-1,66) = 0,83 (В) Вывод: алюминий в щелочной среде способен вытеснить водород из воды. В результате данной окислительно-восстановительной реакции, наряду с водородом, образуется и гидроксид алюминия Al(OH)3, который, как и оксид алюминия Al2O3, обладает амфотерными свойствами. В дальнейшем, гидроксид алюминия будет взаимодействовать со щелочью, которая есть в нашей системе:
Примечание. Гидроксид алюминия является промежуточным соединением. Его не следует указывать в конечных продуктах. Теперь нам остается подвести итоги и написать заключительную реакцию. В левой и правой части оставим только те вещества, которые принимали участие в реакциях и образовались в результате рассмотренных взаимодействий: 2Al + 2Li2S + 4H2O = 2LiHS + 2LiAlO2 + 3H2↑ Примечание. Воду записываем только в левой части реакции (где ее больше). Таким образом в окружающую среду в качестве конечных продуктов поступят: гидросульфид лития, метаалюминат лития и водород. Не забудем также, что среда в этом месте будет щелочной (в данном случае гидролиз – обратимый процесс, при расходовании LiOH новые порции соли Li2S будут гидролизоваться с образованием того же LiOH). Заключение по II части контрольного задания По указанному алгоритму следует рассматривать все контрольные задания II части, которые вы получили. Следует, конечно, понимать, что в каких-то заданиях в результате гидролиза среда может получиться кислой (pH<7), и тогда не только оксид, но и сам металл будет способен растворяться в кислоте. В необходимых случаях реальность такой возможности следует проверить, используя ЭДС реакции. Следует помнить, что если вам в подобном задании дан активный металл (Al, Zn и т.д.) и соль менее активного металла (Cu, Fe и т.д.), то после растворения оксидной пленки активный металл сначала вытеснит менее активный из его соли (см. ряд активности металлов: «Опорный конспект лекций по химии», стр. 140). Будет ли вытесненный неактивный металл далее с чем-то взаимодействовать – зависит от состава кислотной среды. Если среда – раствор азотной кислоты, то будет, если среда – растворы серной, соляной и других сильных кислот, то необходимо предварительно вычислить ЭДС окислительно-восстановительных реакций, как было показано ранее.
2.2.1. Основные положения по II части контрольного задания 1. Оксидную пленку следует учитывать только на активных металлах. 2. При взаимодействии оксидов и гидроксидов активных металлов со щелочью можно давать простейшие формулы солей, хотя будет приветствоваться написание реально существующих формул солей (в рассмотренном примере LiAlO2 – простейшая формула (безводная), реальная формула – LiAl(OH)4). 3. Окислительно-восстановительные реакции необходимо уравнять (в рассмотренной II части контрольного задания это реакция алюминия с водой). 4. В ответах должны быть: реакции гидролиза, запись реакции гидролиза в молекулярном и ионном виде, ЭДС для окислительно-восстановительных реакций, итоговая реакция. Примечание. При подготовке ответов на контрольные задания рекомендуется использовать указанное в тексте основные учебное пособие: «Химия. Опорный конспект лекций для студентов заочной и дистанционной форм обучения». Изд. СПбГТУ, 2001. (См. также список литературы).
|
||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 448; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.242.223 (0.008 с.) |



 Графическая электронная формула будет выглядеть следующим образом:
Графическая электронная формула будет выглядеть следующим образом:
 Образование химической связи энергетически невыгодно.
Образование химической связи энергетически невыгодно.


 Li2S + H2О LiHS + LiOH
Li2S + H2О LiHS + LiOH Li+ + S2- + H2O Li+ + HS- + Li+ + OH-, рН > 7
Li+ + S2- + H2O Li+ + HS- + Li+ + OH-, рН > 7 в сокращенном ионном виде:
в сокращенном ионном виде: Al2O3 + LiOH LiAlO2 + H2O
Al2O3 + LiOH LiAlO2 + H2O 2Al + 6H2O 2Al(OH)3 + 3H2↑
2Al + 6H2O 2Al(OH)3 + 3H2↑ 14. Возьмем величину рН=14, подставив ее в уравнение
14. Возьмем величину рН=14, подставив ее в уравнение
 Al(OH)3 + LiOH LiAlO2 + H2O
Al(OH)3 + LiOH LiAlO2 + H2O


