
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обработка результатов качественного анализаСодержание книги
Поиск на нашем сайте
Результаты экспериментов заносят в журнал, фиксируя изменение цвета раствора, выпадение осадка, помутнение и другие внешние изменения. В таблицу 3 вносят реакции лишь на те катионы и анионы, которые были обнаружены в анализируемом образце.
Таблица 3 – Аналитические реакции катионов и анионов
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОФОРМЛЕНИЮ ОТЧЁТА ПО ЛАБОРАТОРНОЙ РАБОТЕ Отчет должен содержать следующие разделы: - цель работы; - основные теоретические положения качественного анализа; - результаты экспериментальных определений; - таблица с результатами экспериментальных определений; - выводы о проделанной работе; - решение задач.
КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Сформулируйте задачи качественного и количественного анализа. 2. Какими методами и способами можно проводить качественный анализ? 3. В чем заключается сущность дробного и систематического анализа? 4. Какие массы и объёмы анализируемых веществ соответствуют макро-, микро- и полумикроанализу? 5. В чём заключается суть «сухого метода анализа»? 6. На чем основана кислотно-основная классификация катионов? 7. Какие группы анионов Вы знаете? На чём основана их классификация? 8.С помощью каких уравнений химической реакции анализировали неизвестный образец? 9. Какова методика проведения лабораторной работы? 10. Как можно открыть анион СO32- в присутствии SO32- и PO43-? Напишите уравнения реакций.
ЗАДАЧИ
Способы выражения концентраций растворов Концентрацией раствора называется количество растворенного вещества, содержащееся в определенном весовом или объемном количестве раствора или растворителя. Для характеристики состава раствора используются следующие способы выражения концентраций: 1) массовая доля(w). Это доля, которую составляет масса растворённого вещества (mв) от массы раствора (mр-ра):
где m в – масса вещества, кг; m р-ра – масса раствора, кг; 2) массовая доля в процентах(w,%). Это выраженная в процентах доля, которую составляет масса растворённого вещества от массы раствора:
3) молярная концентрация(СМ). Характеризует количество растворённого вещества (nв) в 1 литре раствора:
так как то
где V – объём раствора, л. МВ – молярная масса вещества, кг/моль. Размерность моль/л сокращённо обозначается большой буквой М; 4) нормальная концентрация(
так как
то
где fэ – фактор эквивалентности. Размерность (моль-экв/л) сокращенно обозначается буквой Н. 5) моляльная концентрация(Сm). Характеризует количество растворного вещества (nB), содержащегося в 1000 г растворителя (mр-ля):
или 6) титр (Т). Характеризует массу вещества, содержащуюся в 1 мл раствора:
7) мольная доля(х). Характеризует долю, которая составляет количество растворённого вещества от суммы количества веществ всех компонентов раствора. Мольная доля – величина безмерная.
где nB – количество молей растворенного вещества; nр-ля – количество молей растворителя. Примеры решения задач Задача 1 Вычислите: а) массовую долю в ω %; б) молярную (См); в) нормальную (СN); г) моляльную (Сm) концентрации раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/см3. Чему равен титр (Т) этого раствора?
300 — 18 100 — ω (%) ω (%)= 100.18/300=6 %; б) мольно-объемная концентрация, или молярная концентрация, показывает число молей растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора V∙ρ = 1000 ∙ 1,031 =1031 г. Составляем пропорцию: 300 — 18 1031 — Х х= 1031.18/300=61,86 г.
Молярность раствора получим делением числа граммов Н3РО4 в 1 л раствора на молекулярную массу Н3РО4: См= 61,86/97,99 = 0,63 М;
в) нормальная концентрация, или нормальность, показывает число моль-эквивалентов растворенного вещества, содержащихся в 1 л раствора. Так как 1 г-экв Н3РО4 = М/3=97,99/3 = 32,66 г, то СN = 61,86/32,66=1,89н; г) мольно-весовая концентрация, или моляльность, показывает число грамм-молекул растворенного вещества, содержащихся в 1000 г растворителя. Массу Н3РО4 в 1000 г растворителя находим из соотношения:
282 — 18 1000 — Х Х=1000.18/282 = 68,83. Отсюда Сm = 63,83/97,99 = 0,65 м; д) титром раствора называется количество граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1 л раствора содержится 61,86 г кислоты, то Т = 61,86/1000 = 0,06186 г/см3. Зная нормальность раствора и молярную массу эквивалента растворенного вещества, титр легко найти по формуле
Т = Сн. Мэ(х) /1000.
Ответ: ω (%)= 6%, См=0,63 М; Сm = 0,65 м, Т = 0,06186 г/см3. Задача 2 На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 6,5 н. раствора щелочи. Чему равна нормальность кислоты?
V1/ V2= СN2/ СN1, или V1. CN1= V2.СN2; 50.СN1 = 25.0,5, откуда СN1 =25.0,5/50= 0,25 н. Ответ: СN1 = 0,25 н. Задача 3 К 1 л 10 %-ного раствора КОН (ρ1 = 1,092 г/см3) прибавили 0,5 л 5 %-ного раствора КОН (ρ2 = 1,045 г/см3). Объем смеси довели до 2 л. Вычисляем молярную концентрацию полученного раствора.
Масса 0,5 л 5 %-ного раствора 1045.0,5 = 522,5 г. В растворе содержится КОН: 522,5.5/100= 26,125 г КОН. В общем объеме полученного раствора (2 л) масса КОН составляет 109,2 +26,125 = 135,325 г. Отсюда молярность этого раствора: См= 135,325/2.56,1 = 1,2 М, где 56,1— молярная масса КОН Ответ: См = 1,2 М. Задача 4 Какой объем 96 %-ной кислоты, плотность которой 1,84 г/см3, потребуется для приготовления 3 л 0,4 н раствора?
1,84.96/100 = 1,766 г Н2SO4. Следовательно, для приготовления 3 л 0,4 н. раствора надо взять: 58,848 /1,766 == 33,32 см3 этой кислоты. Ответ: V1 = 33,32 см3. 5.1.2 Задачи для самостоятельного решения 1. Какова массовая доля H2SO4 (в %) в растворе, полученном смешиванием 400 мл 70 %-го раствора кислоты (r=1,61 г/см3) и 500 мл воды? 2. Смешали 500 мл 32%-ного раствора азотной кислоты (r=1,2 г/см3) и 1 л воды. Какова массовая доля полученного раствора в %? 3. Сколько воды надо прибавить к 100 мл 48 %-го раствора азотной кислоты (r=1,303 г/см3), чтобы получить раствор с массовой долей 20 %? 4. Смешали 50 мл раствора серной кислоты, массовая доля H2SO4 в котором 50 % и плотность 1,4 г/см3, и 400 мл раствора кислоты, массовая доля H2SO4 в котором 10 % и плотность 1,07 г/см3. Определить массовую долю в процентах полученного раствора. 5. Какой объём раствора соляной кислоты, массовая доля в HCl в котором 20 % и плотность 1100 кг/м3 требуется для приготовления 1 л раствора этой кислоты с массовой долей HCl 10,17 % и плотностью 1050 кг/м3? 6. Из 700 мл раствора соляной кислоты с массовой долей HCl 60 % и плотностью 1,498 г/мл3 упариванием удалили 200 г воды. Чему равна концентрация оставшегося раствора? 7. Какой объём раствора КОН с плотностью 1,538 г/см3 и массовой долей 50 % требуется для приготовления 3 л раствора с плотностью 1,048 г/см3 и массовой долей 6 %.
8. Сколько литров воды нужно прибавить к 1 л 10 %-ного раствора аммиака (r=0,958 г/см3), чтобы получить 1,2 %-ный его раствор? 9. Смешали 10 см3 10 %-го раствора азотной кислоты (плотность 1,056 г/см3) и 100 мл 30 %-го раствора азотной кислоты (плотность 1,184 г/см3). Вычислите массовую долю азотной кислоты полученного раствора. 10. Сколько миллилитров 5 %-ного (плотность 1,045 г/см3) и 30 %-го (плотность 1,299 г/см3) раствора едкого кали требуется для приготовления 500 мл 10 %-го раствора? Задачи на расчёт рН Примеры решения задач
Внимание! При расчете рН следует использовать молярную концентрацию ионов Н+ и ОН- (С(Н+), С(ОН-), моль/л). Задача1 Рассчитать рН в 0,025 М растворе хлороводородной кислоты.
Задача 2 Рассчитать рН 0,015 М раствора муравьиной кислоты. Решение: HCOOH — слабая кислота, поэтому
рН= – lg 5,4
Задача 3 Вычислите рН раствора NaOH, полученного разбавлением 10 мл раствора NaOH с w = 20 % до объема 500 мл. Решение: Находим плотность раствора NaOH с w = 20 %, r = 1,219 г/см3. Рассчитаем массу NaOH в 10 мл раствора: 100 мл раствора содержит 20 г 10,0 мл раствора «–» х х. 10. 20. r/100 = 10. 20. 1,219/100 = 2,438 г. Находим молярную концентрацию полученного раствора NaOH. В 500 мл раствора содержится 2,438 г NaOH, а в 1 л 4,876 г, МNaOH = 40 г/моль, С = 4,876/40 = 0,1219 моль/л. Считая ионизацию NaOH полной, имеем С(ОН-) = 0,1219 моль/л. рОН = – lg С(ОН-) = – lg 0,1219 = 0,91. 5.2.2 Задачи для самостоятельного решения 1. Найти рН растворов, содержащих: а) [H+] = 2,0 .10- 4 г- ион/дм3 и б) [OH-] = 8,0.10-3 г- ион/дм3. 2. Чему равна концентрация ацетат-иона в 0,001М растворе уксусной кислоты?
3. Рассчитать значения рН раствора, полученного при сливании 40 см3 0,2 М раствора уксусной кислоты и 20 см3 0,1 М раствора гидроксида натрия. 4. Рассчитать рН и степень диссоциации 1М раствора гидроксида аммония. 5. К 15,00 см3 0,1 М раствора КОН добавлено 17,50 см3 0,084 М раствора НС1. 6. К 50,00 см3 0,1 М раствора НСl добавлено 49,95 см3 0,1 М раствора NaOH. 7. К 20,00 см3 0,12 М раствора NaOH добавлено 5,20 см3 0,24 М раствора НСl. 8. К 15,00 см3 0,1М раствора едкого калия добавлено 18,15 см3 0,084 М раствора азотной кислоты. 9.Рассчитать рН в 0,025 М растворе хлороводородной кислоты. 10.Рассчитать рН 0,01 М раствора уксусной кислоты.
ОСНОВНЫЕ ТРЕБОВАНИЯ ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ При работе в лаборатории аналитической химии следует соблюдать следующие правила: 1. К работе допускаются лица, прошедшие инструктаж и обучение безопасным методам работы.
2. Нарушивший правила ТБ подвергается в обязательном порядке внеочередному инструктажу и проверке знаний. 3. Каждый работающий должен иметь халат и салфетку для вытирания посуды. 4. Категорически запрещается в лаборатории принимать пищу и пить воду. 5. До начала выполнения эксперимента необходимо изучить свойства веществ, с которыми предстоит работать, а также методику выполнения эксперимента. 6. Категорически запрещается выполнение любых экспериментов, не предусмотренных планом лабораторных работ. 7. Работы, связанные с использованием летучих и неприятно пахнущих веществ, а также с концентрированными кислотами, необходимо выполнять только в вытяжном шкафу. 8. При работе с концентрированными растворами кислот и щелочей надевать защитные очки или маску. 9. В лаборатории запрещается носить контактные линзы, ювелирные изделия, широкополую одежду и длинные волосы. 10. При применении хромовой смеси для мытья посуды необходимо соблюдать особую осторожность, т.к. она может причинить химические ожоги. 11. При использовании электронагревательных приборов нужно проверить заземление приборов и их исправность. 12. По окончании работы следует убрать рабочее место, вымыть посуду, выключить приборы, сдать рабочее место дежурному студенту или преподавателю.
ЛИТЕРАТУРА 1. Аналитическая химия. В 3 т. Т.1 Методы идентификации и определения веществ: учеб. для студ. вузов /А. А. Белюстин [и др.]; под ред. Л. Н. Москвина. – М: Издательский центр Аакадемия», 2008. - 576 с. 2. Васильев, В. П. Аналитическая химия. В 2 кн. Кн. 1. Аналитическая химияя / В. П. Васильев. – М: Дрофа, 2003. - 384 с.
3. Основы аналитической химии /под ред. Ю. А. Золотова.—М.: Химия, 1999. — Кн. 1-2. - 380 с. 4. Кунце, У., Основы качественного и количественного анализа./У. Кунце, Г. Шведт. – М.: Мир,1997. - 424 с.
Министерство образования и науки РФ Бийский технологический институт (филиал) федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Алтайский государственный технический университет Им. И.И. Ползунова»
Н. В.Степанова КАЧЕСТВЕННЫЙ АНАЛИЗ Методические рекомендации для выполнения лабораторной работы по дисциплине «Аналитическая химия» для студентов специальности 240300 «Химическая технология энергонасыщенных материалов и изделий», направлений подготовки 240700.62«Биотехнология» и 260100 «Продукты питания из растительного сырья» всех форм обучения
Н. В.Степанова Зав. кафедрой……………………...…………....А.Л. Верещагин
Председатель ФК МКО………………..………В.В. Еремина
Нормоконтролер………………............……….Е.А. Морозова
Зав. библиотекой……………………….……….О.В. Перышкина
Редактор…………………….…………………...
Первый зам. директора по УР…………..… ….В.А. Харитонов
Бийск Издательство Алтайского государственного технического университета им. И.И. Ползунова
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 370; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.177.172 (0.008 с.) |

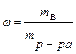 ,
, ,
, моль/л
моль/л
 ,
, ). Характеризует количество вещества эквивалента (nэ), содержащегося в 1 литре раствора:
). Характеризует количество вещества эквивалента (nэ), содержащегося в 1 литре раствора: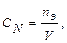 моль·экв/л
моль·экв/л
 ,
,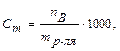 (моль/1000 г)
(моль/1000 г)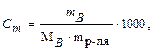 (моль/1000г);
(моль/1000г); г/мл;
г/мл;

 , следовательно
, следовательно = 5,4.10-4
= 5,4.10-4


