
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кафедра промышленной теплоэнергетиткиСодержание книги
Поиск на нашем сайте
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ Московский государственный индустриальный университет Кафедра промышленной теплоэнергетитки С.Д. Корнеев, Л.А. Марюшин ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ТЕПЛОТЕХНИКИ Курс лекций для студентов Специальности 140104 «Промышленная теплоэнергетика»
МОСКВА 2010 СОДЕРЖАНИЕ
Вводная лекция по дисциплине «Теоретические основы теплотехники» Преподаватели: Раздел «Термодинамика»- Марюшин Леонид Александрович, к.т.н., доцент, заведующий кафедрой 37 промышленной теплоэнергетики ГОУ МГИУ. Раздел «Тепломассобмен»- Корнеев Сергей Дмитриевич, д.т.н., профессор кафедры 37 промышленной теплоэнергетики ГОУ МГИУ.
В последние годы ученые всего мира со все большим беспокойством говорят о повышении концентрации СО2 в атмосфере. Если эти опасения подтвердятся, человечеству в не таком уж отдаленном будущем придется резко ограничить потребление углеродсодержащих топлив. Кроме выбросов СО2 топливосжигающие и теплоэнергетические установки производят тепловые загрязнения (выбросы нагретой воды и газов), химические (оксиды серы и азота), золу и сажу, которые с увеличением масштаба производства также создают серьезные проблемы. Однако экономические факторы стимулируют резкое увеличение степени использования добываемого топлива. Вместе с тем пока еще энергетическая эффективность многих технологических процессов чрезвычайно низка, ибо технологи, разрабатывая соответствующие процессы, зачастую не ставили во главу угла вопросы экономии топлива. Высокие цены на топливо (прежде всего нефть) на мировом рынке стимулируют разработку энергосберегающих технологий. Главная роль в разработке менее энергоемких технологий принадлежит технологам. Эту задачу невозможно решить без глубоких знаний основных законов теплотехники. Сегодня выгоднее вкладывать средства не в увеличение добычи топлива, чтобы продолжать расходовать его с низкой эффективностью, а в разработку технологических процессов, обеспечивающих более экономное его использование. В целом более 90 % всей используемой человечеством энергии приходится на ископаемые органические топлива. Это определяет роль теплотехники – общеинженерной дисциплины, изучающей методы получения, преобразования, передачи, и использования теплоты и связанных с этим аппаратов и устройств.
Цели и задачи учебной дисциплины Дисциплина "Теоретические основы теплотехники" изучается студентами специальности "Промышленная теплоэнергетика". Целью введения дисциплины является получение знаний по расчету, работе, совершенствованию теплотехнического оборудования, широко используемого в промышленности и энергетике: газотурбинных двигателей и установок, паротурбинных установок, ядерных энергетических установок, компрессоров, холодильного и теплообменного оборудования, тепловых насосов. Задачей учебной дисциплины является: • изучение основных законов термодинамики и переноса теплоты; • изучение аналитических и экспериментальных методов исследования процессов тепло - и массообмена; • овладение методами расчета параметров и процессов идеального газа и реальных рабочих тел; • овладение количественными и качественными методами термодинамического анализа процессов и циклов тепловых двигателей и аппаратов с целью повышения тепловой экономичности, уменьшения капитальных затрат, уменьшения отрицательного воздействия на окружающую среду; • умение произвести необходимые тепловые расчеты при проектно - Общие методические указания Курс "Теоретические основы теплотехники" включает в себя две дисциплины: "Техническая термодинамика" и "Теплопередача". Обе дисциплины являются фундаментальными в системе подготовки инженеров-теплотехников. Техническая термодинамика изучает закономерности превращения энергии. Теплопередача изучает законы самопроизвольного переноса теплоты. На основе этих дисциплин осуществляется расчет и проектирование всех тепловых двигателей - паровых и газовых турбин, реактивных и ракетных двигателей, двигателей внутреннего сгорания, а также всевозможного технологического оборудования - компрессоров, сушильных и холодильных установок, тепловых насосов и т.д. Дисциплина "Теоретические основы теплотехники" является базовой для изучения прикладных теплотехнических дисциплин. При изучении дисциплины рекомендуется руководствоваться программой курса и методическими указаниями к ней, самостоятельно овладеть теорией по учебникам и выполнить 3 контрольные работы, каждая из которых содержит 4-5 задач (обязательных) и 4 вопроса. Ниже приводится список литературы, который включает в себя основные учебники, справочные таблицы, которые содержат краткие теоретические основы, необходимые для решения контрольных работ, примеры решения задач, пояснения к решению контрольных задач и ответы на контрольные вопросы. Таблицы необходимы для нахождения параметров технически важных газов (воздуха, азота, углекислого газа и др.) а также воды и водяного пара. Перед выполнением контрольных работ рекомендуется прослушать обзорные лекции по основным разделам курса, которые читаются в период экзаменационных сессий. В это же время студенты выполняют лабораторно -практические задания под руководством преподавателя. Цель их - более глубокое усвоение теоретического материала и приобретение практических навыков в проведении эксперимента. Требования, предъявляемые на экзамене по дисциплине - знание теории и понимание физической сущности рассматриваемых в курсе вопросов, а также умение применить теоретические знания к решению практических задач.
Основная литература 1. Баскаков А.П. Теплотехника.-М.:Энергоатомиздат, 1991.-244 с. 2. Исаченко В.П., Осипова В.А., Сукомел А.С. Теплопередача. Энергия,1971 3. Нащокин В.В. Техническая термодинамика и теплопередача. Высшая школа.1980. 4. Александров А.А., Григорьев Б.А. Таблицы теплофизических свойств воды и водяного пара. Справочник.-М.: Издательство МЭИ, 19994.- 168 с. 5. Сборник задач по технической термодинамике. / Андрианова Т.Н. и др. -М.: Энергоиздат, 1981.
Дополнительная литература 1. Ривкин С.Л. Термодинамические свойства газов. -М.: Энергоиздат, 1987. 2. Вукалович М.П., Ривкин С.Л., Александров А.А. Таблицы теплофизических свойств воды и водяного пара. - М.: Издательство стандартов, 1969. 3. Кириллин В.А., Сычев В.В, Шейндлин А.Е. Техническая термодинамика. -М.: Энергоатомиздат, 1983. 4. Краснощеков Е.А., Сукомел А.С. Задачник по теплопередаче. -М.: Энергия, 1980.
ТЕМА 1
Термодинамика изучает законы превращения энергии в различных процессах, происходящих в макроскопических системах и сопровождающихся тепловыми эффектами. Макроскопической системой называется любой материальный объект, состоящий из большого числа частиц. Размеры макроскопических систем несоизмеримо больше размеров молекул и атомов. В зависимости от задач исследования рассматривают техническую или химическую термодинамику, термодинамику биологических систем и т. д. Техническая термодинамика изучает закономерности взаимного превращения тепловой и механической энергии и свойства тел, участвующих в этих превращениях. Вместе с теорией теплообмена она является теоретическим фундаментом теплотехники. На ее основе осуществляют расчет и проектирование всех тепловых двигателей, а также всевозможного технологического оборудования. Рассматривая только макроскопические системы, термодинамика изучает закономерности тепловой формы движения материи, обусловленные наличием огромного числа непрерывно движущихся и взаимодействующих между собой микроструктурных частиц (молекул, атомов, ионов). Физические свойства макроскопических систем изучаются статистическими термодинамическим методами. Статистический метод основан на использовании теории вероятностей и определенных моделей строения этих систем и представляет собой содержание статистической физики. Термодинамический метод не требует привлечения модельных представлений о структуре вещества и является феноменологическим (т. е. рассматривает «феномены» — явления в целом). При этом все основные выводы термодинамики можно получить методом дедукции, используя только два основных эмпирических закона термодинамики. В дальнейшем исходя из термодинамического метода мы будем для наглядности использовать молекулярно-кинетические представления о структуре вещества. Термодинамическая система Термодинамическая система представляет собой совокупность материальных тел, находящихся в механическом и тепловом взаимодействиях друг с другом и с окружающими систему внешними телами («внешней средой»). Выбор системы произволен и диктуется условиями решаемой задачи. Тела, не входящие в систему, называют окружающей средой. Систему отделяют от окружающей среды контрольной поверхностью (оболочкой). Так, например, для простейшей системы — газа, заключенного в цилиндре под поршнем, внешней средой является окружающий воздух, а контрольными поверхностями служат стенки цилиндра и поршень. Механическое и тепловое взаимодействия термодинамической системы осуществляются через контрольные поверхности. При механическом взаимодействии самой системой или над системой совершается работа. (В общем случае на систему могут действовать также электрические, магнитные и другие силы, под воздействием которых система будет совершать работу. Эти виды работ также могут быть учтены в рамках термодинамики, но нами в дальнейшем рассматриваться не будут). В нашем примере механическая работа производится при перемещении поршня и сопровождается изменением объема. Тепловое взаимодействие заключается в переходе теплоты между отдельными телами системы и между системой и окружающей средой. В рассматриваемом примере теплота может подводиться к газу через стенки цилиндра. В самом общем случае система может обмениваться со средой и веществом (массообменное взаимодействие). Такая система называется открытой. Потоки газа или пара в турбинах и трубопроводах — примеры открытых систем. Если вещество не проходит через границы системы, то она называется закрытой. В дальнейшем, если это специально не оговаривается, мы будем рассматривать закрытые системы. Термодинамическую систему, которая не может обмениваться теплотой с окружающей средой, называют теплоизолированной или адиабатной. Примером адиабатной системы является газ, находящийся в сосуде, стенки которого покрыты идеальной тепловой изоляцией, исключающей теплообмен между заключенным в сосуде газом и окружающими телами. Такую изоляционную оболочку называют адиабатной. Система, не обменивающаяся с внешней средой ни энергией, ни веществом, называется изолированной (или замкнутой). Простейшей термодинамической системой является рабочее тело, осуществляющее взаимное превращение теплоты и работы. В двигателе внутреннего сгорания, например, рабочим телом является приготовленная в карбюраторе горючая смесь, состоящая из воздуха и паров бензина.
Уравнение состояния Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которая называется уравнением состояния. Опыт показывает, что удельный объем, температура и давление простейших систем, которыми являются газы, пары или жидкости, связаны термическим уравнением состояния вида Уравнению состояния можно придать другую форму: Эти уравнения показывают, что из трех основных параметров, определяющих состояние системы, независимыми являются два любых. Для решения задач методами термодинамики совершенно необходимо знать уравнение состояния. Однако оно не может быть получено в рамках термодинамики и должно быть найдено либо экспериментально, либо методами статистической физики. Конкретный вид уравнения состояния зависит от индивидуальных свойств вещества. Уравнение состояния идеальных газов Из уравнений (1.1) и (1.2) следует, что Рассмотрим 1 кг газа. Учитывая, что в нем содержится N молекул и, следовательно, Постоянную величину Nk, отнесенную к 1 кг газа, обозначают буквой R и называют газовой постоянной. Поэтому
Полученное соотношение представляет собой уравнение Клапейрона. Умножив (1.3) на М, получим уравнение состояния для произвольной массы газа М:
Уравнению Клапейрона можно придать универсальную форму, если отнести газовую постоянную к 1 кмолю газа, т. е. к количеству газа, масса которого в килограммах численно равна молекулярной массе μ. Положив в (1.4) М= μ и V=V μ, получим для одного моля уравнение Клапейрона — Менделеева:
Здесь В соответствии с законом Авогадро (1811г.) объем 1 кмоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4136 м3, поэтому
Газовая постоянная 1 кг газа составляет Уравнение состояния реальных газов В реальных газах в отличие от идеальных существенны силы межмолекулярных взаимодействий (силы притяжения, когда молекулы находятся на значительном расстоянии, и силы отталкивания при достаточном сближении их друг с другом) и нельзя пренебречь собственным объемом молекул. Наличие межмолекулярных сил отталкивания приводит к тому, что молекулы могут сближаться между собой только до некоторого минимального расстояния. Поэтому можно считать, что свободный для движения молекул объем будет равен
Силы притяжения действуют в том же направлении, что и внешнее давление, и приводят к возникновению молекулярного (или внутреннего) давления. Сила молекулярного притяжения каких-либо двух малых частей газа пропорциональна произведению числа молекул в каждой из этих частей, т. е. квадрату плотности, поэтому молекулярное давление обратно пропорционально квадрату удельного объема газа: рмол = а/ v 2, где а — коэффициент пропорциональности, зависящий от природы газа. Отсюда получаем уравнение Ван-дер-Ваальса (1873 г.):
При больших удельных объемах и сравнительно невысоких давлениях реального газа уравнение Ван-дер-Ваальса практически вырождается в уравнение состояния идеального газа Клапейрона, ибо величина a / v 2 (по сравнению с p) и b (по сравнению с v) становятся пренебрежимо малыми. Уравнение Ван-дер-Ваальса с качественной стороны достаточно хорошо описывает свойства реального газа, но результаты численных расчетов не всегда согласуются с экспериментальными данными. В ряде случаев эти отклонения объясняются склонностью молекул реального газа к ассоциации в отдельные группы, состоящие из двух, трех и более молекул. Ассоциация происходит вследствие несимметричности внешнего электрического поля молекул. Образовавшиеся комплексы ведут себя как самостоятельные нестабильные частицы. При столкновениях они распадаются, затем вновь объединяются уже с другими молекулами и т. д. По мере повышения температуры концентрация комплексов с большим числом молекул быстро уменьшается, а доля одиночных молекул растет. Большую склонность к ассоциации проявляют полярные молекулы водяного пара. Термодинамический процесс Изменение состояния термодинамической системы во времени называется термодинамическим процессом. Так, при перемещении поршня в цилиндре объём, а с ним давление и температура находящегося внутри газа будут изменяться, будет совершаться процесс расширения или сжатия газа. Как уже отмечалось, система, выведенная из состояния равновесия, и предоставленная при постоянных параметрах окружающей среды самой себе, через некоторое время вновь придет в равновесное состояние, соответствующее этим параметрам. Такое самопроизвольное (без внешнего воздействия) возвращение системы в состояние равновесия называется релаксацией, а промежуток времени, в течение которого система возвращается в состояние равновесия, называется временем релаксации. Для разных процессов он различно: если для установления равновесного давления в газе требуется всегда, то для выравнивания температуры в объеме того же газа нужны десяти; минут, а в объеме нагреваемого твердой тела — иногда несколько часов. Термодинамический процесс называется равновесным, если все параметры системы при его протекании меняются достаточно медленно по сравнению с соответствующим процессом релаксации. В этом случае система фактически все время находится в состоянии равновесия с окружающей средой, чем и определяется название процесса. Чтобы процесс был равновесным, скорость изменения параметров системы
где А — параметр, наиболее быстро изменяющийся в рассматриваемом процессе; с рел — скорость изменения этого параметра в релаксационном процессе; τ рел — время релаксации. Рассмотрим, например, процесс сжатия газа в цилиндре. Если время смещения поршня от одного положения до другого существенно превышает время релаксации, то в процессе перемещения поршня давление и температура успеют выровняться по всему объему цилиндра. Это выравнивание обеспечивается непрерывным столкновением молекул, в результате чего подводимая от поршня к газу энергия достаточно быстро и равномерно распределяется между ними. Если последующие смещения поршня будут происходить аналогичным образом, то состояние системы в каждый момент времени будет практически равновесным. Таким образом, равновесный процесс состоит из непрерывного ряда последовательных состояний равновесия, поэтому в каждой его точке состояние термодинамической системы можно описать уравнением состояния данного рабочего тела. Именно поэтому классическая термодинамика в своих исследованиях оперирует только равновесными процессами. Они являются удобной идеализацией реальных процессов, позволяющей во многих случаях существенно упростить решение задачи. Такая идеализация вполне обоснована, так как условие (1.8) выполняется на практике достаточно часто. Поскольку механические возмущения распространяются в газах со скоростью звука, процесс сжатия газа и цилиндре будет равновесным, если скорость перемещения поршня много меньше скорости звука. Процессы, не удовлетворяющие условию Теплоемкость газов Отношение количества теплоты
Обычно теплоемкость относят к единице количества вещества и в зависимости от выбранной единицы различают: - удельную массовую теплоемкость c, отнесенную к 1 кг газа, Дж/(кг·К); - удельную объемную теплоемкость c´, отнесенную к количеству газа, содержащегося в 1 м3 объема при нормальных физических условиях, Дж/(м3·К); - удельную мольную теплоемкость Зависимость между удельными теплоемкостями устанавливается очевидными соотношениями: Здесь Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса, поэтому теплоемкость является функцией процесса. Это означает, что одно и то же рабочее тело в зависимости от процесса требует для своего нагревания на 1 К различного количества теплоты. Численно величина с изменяется в пределах от +∞ до -∞. В термодинамических расчетах большое значение имеют: - теплоемкость при постоянном давлении
равная отношению количества теплоты - теплоемкость при постоянном объеме
равная отношению количества теплоты, подведенной к телу в процессе при постоянном объеме, к изменению температуры тела. В соответствии с первым законом термодинамики для закрытых систем, в которых протекают равновесные процессы
Для изохорного процесса (v =const) это уравнение принимает вид
т. е. теплоемкость тела при постоянном объеме равна частной производной от его внутренней энергии по температуре и характеризует темп роста внутренней энергии в изохорном процессе с увеличением температуры. Для идеального газа Для изобарного процесса () из уравнения (2.16) и (2.14) получаем
или
Это уравнение показывает связь между теплоемкостями ср и сv. Для идеального газа оно значительно упрощается. Действительно, внутренняя энергия идеального газа определяется только его температурой и не зависит от объема, поэтому
Это соотношение называется уравнением Майера и является одним из основных в технической термодинамике идеальных газов. В процессе v =const теплота, сообщаемая газу, идет лишь на изменение его внутренней энергии, тогда как в процессе р = const теплота расходуется и на увеличение внутренней энергии и на совершение работы против внешних сил. Поэтому ср больше сv на величину этой работы. Для реальных газов Обычно теплоемкости определяются экспериментально, но для многих веществ их можно рассчитать методами статистической физики. Числовое значение теплоемкости идеального газа позволяет найти классическая теория теплоемкости, основанная на теореме о равномерном распределении энергии по степеням свободы молекул. Согласно этой теореме внутренняя энергия идеального газа прямо пропорциональна числу степеней свободы молекул и энергии kТ/2, приходящейся на одну степень свободы. Для 1 моля газа
где Nо — число Авогадро; i — число степеней свободы (число независимых координат, которые нужно задать для того, чтобы полностью определить положение молекулы в пространстве). Молекула одноатомного газа имеет три степени свободы соответственно трем составляющим в направлении координатных осей, на которые может быть разложено поступательное движение. Молекула двухатомного газа имеет пять степеней свободы, так как помимо поступательного движения она может вращаться около двух осей, перпендикулярных линии, соединяющей атомы (энергия вращения вокруг оси, соединяющей атомы, равна нулю, если атомы считать точками). Молекула трехатомного и вообще многоатомного газа имеет шесть степеней свободы: три поступательных и три вращательных. Поскольку для идеального газа
Результаты классической теории теплоемкости достаточно хорошо согласуются с экспериментальными данными в области комнатных температур (табл. 2.1), однако основной вывод о независимости от температуры эксперимент не подтверждает. Расхождения, особенно существенные в области низких и достаточно высоких температур, связаны с квантовым поведением молекул и находят объяснения в рамках квантовой теории теплоемкости. Теплоемкость некоторых газов при t= 0°С в идеально-газовом состоянии:
Эта теория устанавливает, прежде всего, несправедливость теоремы о равномерном распределении энергии по степени свободы в области низких и высоких температур. С уменьшением температуры газа происходит «вымораживание» числа степеней свободы молекулы. Так, для двухатомной молекулы происходит «вымораживание» вращательных степеней свободы и она вместо пяти имеет три степени свободы, а следовательно, и меньшую внутреннюю энергию и теплоемкость. С увеличением температуры у многоатомных молекул происходит возбуждение внутренних степеней свободы за счет возникновения колебательного движения атомов молекулы (молекула становится осциллятором). Это приводит к увеличению внутренней энергии, а следовательно, и теплоемкости с ростом температуры. Теплоемкость реального газа зависит от давления, правда, очень слабо. Поскольку теплоемкость реального газа зависит от температуры, в термодинамике различают истинную и среднюю теплоемкости. Средней теплоемкостью с ср данного процесса в интервале температур от t1 до t2 называется отношение количества теплоты, сообщаемой газу, к разности конечной и начальной температур:
Выражение
определяет теплоемкость при данной температуре или так называемую истинную теплоемкость. Из * следует, что
поэтому
Для практических расчетов теплоемкости всех веществ сводят в таблицы, причем с целью сокращения объема таблиц средние теплоемкости приводят в них для интервала температур от 0 до t.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 216; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.24.176 (0.011 с.) |

 Предмет и метод термодинамики
Предмет и метод термодинамики .
.
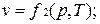
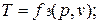
 .
. , получим:
, получим:  .
. , или
, или  . (1.3)
. (1.3)
 . (1.4)
. (1.4) .
.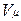 — объем киломоля газа, а
— объем киломоля газа, а  — универсальная газовая постоянная.
— универсальная газовая постоянная.
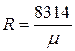 .
. , где b — тот наименьший объем, до которого можно сжать газ. В соответствии с этим длина свободного пробега молекул уменьшается и число ударов о стенку в единицу времени, а следовательно, и давление увеличивается по сравнению с идеальным газом в отношении
, где b — тот наименьший объем, до которого можно сжать газ. В соответствии с этим длина свободного пробега молекул уменьшается и число ударов о стенку в единицу времени, а следовательно, и давление увеличивается по сравнению с идеальным газом в отношении 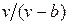 , т. е.
, т. е. .
.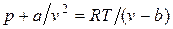 ,
,
 или
или .
. должна удовлетворять соотношению
должна удовлетворять соотношению
 , полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела
, полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела  , называется теплоемкостью тела в данном процессе:
, называется теплоемкостью тела в данном процессе: .
. , отнесенную к одному киломолю, Дж/(кмоль·К).
, отнесенную к одному киломолю, Дж/(кмоль·К). ;
; 
 — плотность газа при нормальных условиях.
— плотность газа при нормальных условиях.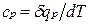 ,
, , сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT
, сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT , (1.5)
, (1.5) , и
, и .
. , и, учитывая (1.5), получаем, что
, и, учитывая (1.5), получаем, что ,
, /
/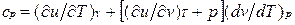

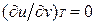 и, кроме того, из уравнения состояния следует
и, кроме того, из уравнения состояния следует  , откуда
, откуда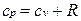 .
. , поскольку при их расширении (при p =const) совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты.
, поскольку при их расширении (при p =const) совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты. ,
, , то мольные теплоемкости одно-, двух- и многоатомных газов равны соответственно:
, то мольные теплоемкости одно-, двух- и многоатомных газов равны соответственно: ;
; 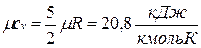 ;
;  .
.
 *
*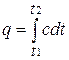
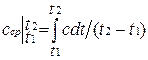 .
.


