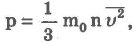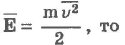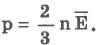Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Перенос тепла в живых организмах.Содержание книги
Поиск на нашем сайте
Благодаря теплопродукции температура тела у теплокровных животных обладает удивительным постоянством и не зависит от температуры внешней среды. Лишь только при длительном и глубоком охлаждении температура тела может понижаться с одновременным значительным ослаблением всех функций организма. Поскольку внешние условия, а также физиологические процессы могут меняться в определенных пределах, то для поддержания стационарного температурного состояния живые организмы в ходе эволюции выработали определенные механизмы, которые могут немного понижать или повышать температуру, увеличивая или уменьшая теплообмен с внешней средой. При повышении температуры среды в организме возникают процессы, приводящие в действие термопонижающие центры, в результате чего происходит расширение кровеносных сосудов, увеличение потоотделения, учащение дыхания. Но наибольшая роль в этом процессе принадлежит переносу тепла кровью, обладающей большой теплоемкостью. Перенос тепла потоком крови аналогичен процессам в любом теплообменнике. Кровь выталкивается из левого желудочка сердца («двигатель»), проходит через «нагреватель» (ткани), через «радиатор» (поверхностные части тела, легкие), отдающий теплоту во внешнюю среду, и поступает обратно в сердце, в его правый желудочек.
№15 Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. Идеальным принято считать газ, если: а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела; г) движение каждой молекулы подчиняется классическим законам динамики Ньютона. Основными параметрами идеального газа являются давление, объем и температура. Реальный разреженный газ приблизительно ведет себя как идеальный газ. Одним из первых и важных успехов молекулярно-кинетической теории было качественное и количественное объяснение давления газа на стенки сосуда. Качественное объяснение заключается в том, что молекулы газа при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела и передают свои импульсы стенкам сосуда. На основании использования основных положений молекулярно-кинетической теории было получено основное уравнение молекулярно-кинетической теории идеального газа, которое устанавливает связь между макроскопической величиной - давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
где р - давление, m0- масса молекулы, n - концентрация (число молекул в единице объема), v2- средний квадрат скорости молекул. Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы
можно записать:
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
16. Реальные газы.Уравнение состояния.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
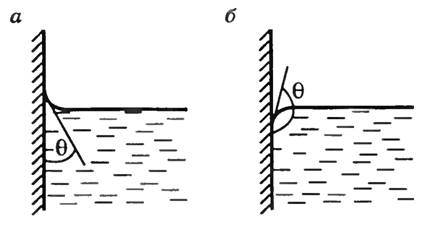
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона: pV=Zr(p,T)*m/M*R*T где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная. Уравнение состояния. Для одного моля газа Ван-дер-Ваальса оно имеет вид: (p+a/V2)(V-b)=RT где p — давление, V — молярный объём, T — абсолютная температура, R — универсальная газовая постоянная. Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так (p+av2/V2)(V/v-b)=RT где v - объем. P.S. ребята.формулу нормально не скинуть.так что пишу обозначение.. V2 - это значит большое V в квадрате.за какой буквой цифра стоит.значит та буква и в квадрате.)) a/V2 - черточка значит деление в столбик.что стоит первое то и на верху) *- это умножение. №17 На границе соприкосновения твердых тел с жидкостями наблюдаются явления смачивания, состоящие в искривлении свободной поверхности жидкости около твердой стенки сосуда. Поверхность жидкости, искривленная на границе с твердым телом, называется мениском. Линия, по которой мениск пересекается с твердым телом, называется периметром смачивания. Жидкость называется смачивающей твердое тело, если краевой угол острый 0 <О< 90 градусов (см.рис. а) Для жидкостей, не смачивающих твердое тел, краевой угол тупой: 90 <О< 180 (см. рис. б).
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 674; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.147.141 (0.008 с.) |