Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
На рисунке 4.19 схема аппарата с рубашкой для нагревания глухим паром.Содержание книги
Поиск на нашем сайте

НАГРЕВАНИЕ ТОПОЧНЫМИ ГАЗАМИ Нагревание топочными газами — самый старый способ обогрева в химической промышленности. Этим способом осуществляется нагревание до температур 180—1000° С. Дымовые газы образуются при сжигании твердого, жидкого или газообразного топлива (преимущественно при атмосферном давлении) в топках или печах различной конструкции. Особенностей нагрева дымовыми газами являются «жесткие» условия нагревания: значительные перепады температур. Благодаря большим температурным перепадам при нагревании дымовыми газами достигаются высокие тепловые нагрузки. Однако при этом методе нагревания трудно регулировать процесс и избежать перегрева материалов из-за неравномерности обогрева; кроме того, при разбавлении дымовых газов большим количеством воздуха происходит окисление металлов. Следует отметить огнеопасность обогрева дымовыми газами. Непосредственное нагревание топочными газами осуществляется в трубчатых печах, а также в печах для реакционных котлов или автоклавов. Простейшая трубчатая печь изображена на рисунке 4.20. Топочные газы образуются в топке 1, куда вводится топлива (твердое, жидкое, газообразное) и необходимый для горения воздух. Для понижения температуры газов в топочном пространстве в топочную камеру 2 через окно 3 вентилятором 4 нагнетается воздух. Топочные газы омывают трубчатый змеевик 5, расположенный в шахте 6, а затем удаляется через боров 7.
НАГРЕВАНИЕ ПРОМЕЖУТОЧНЫМИ ТЕПЛОНОСИТЕЛЯМИ При нагревании многих материалов для сохранения качества продуктов или обеспечения безопасной работы недопустим даже кратковременный их перегрев. В этих случаях для обогрева применяют промежуточные теплоносители, которые сначала нагреваются топочными газами, а затем передают воспринятое тепло обрабатываемым материалам. В качестве промежуточных теплоносителей применяют минеральные масла, перегретую воду, высокотемпературные органические теплоносители, расплавленные смеси солей и др. Нагревание топочными газами через жидкостную баню относится к простейшим способам нагревания промежуточными теплоносителями. В этом случае аппарат снабжают рубашкой, заполненной, например, маслом. Топочные газы омывают рубашку и передают тепло маслу, а масло через стенки аппарата — обрабатываемым материалам. Для повышения эффективности нагревания используют установки с циркулирующим жидким промежуточным теплоносителем. Принципиальная схема такой установки показана на рис. 4.21 Жидкий теплоноситель нагревается в змеевике 2 печи 1. В результате уменьшения при нагревании удельного веса теплоносителя он перемещается по трубопроводу вверх к обогреваемому аппарату 3. Теплоноситель проходит по змеевику, расположенному вокруг этого аппарата, и отдает тепло нагреваемому материалу.
Температура теплоносителя при этом снижается, а удельный вес увеличивается, в результате чего он стекает по трубопроводу вниз. Таким образом осуществляется замкнутая циркуляция теплоносителя. НАГРЕВАНИЕ ЭЛЕКТРИЧЕСКИМ ТОКОМ В химической технике довольно широко применяется нагревание электрическим током в различных электрических печах. При нагревании электрическим током можно легко и очень точно регулировать процесс при равномерном обогреве. По способу превращения электрической энергии в тепловую различают электрические печи сопротивления индукционные и дуговые. Электрические печи сопротивления делятся на печи прямого действия и печи косвенного действия. В электрических печах прямого действия нагреваемое тело включается непосредственно в электрическую цепь и нагревается при прохождении через него электрического тока. Часто печь прямого действия представляет собой аппарат, корпус которого является одним из электродов; другой электрод размещают в аппарате. Между электродами помещают жидкие или расплавленные нагреваемые материалы. Электрические печи сопротивления косвенного действия получили большое распространение. В них тепло выделяется при прохождении электрического тока по специальным нагревательным элементам; выделяющееся тепло передается материалу лучеиспусканием, теплопроводностью и конвекцией. В таких печах осуществляется нагревание до температур 1000—1100° С. Схема такой печи показана на рис. 4.22.
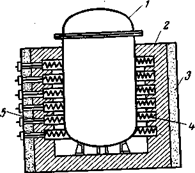
Футеровка печи 2 выполнена из огнеупорного кирпича. В пазах футеровки уложены спиральные нагревательные элементы 4, к которым подводится ток через электрошины 5. Тепло, выделяющееся при прохождении электрического тока через спиральные нагревательные элементы, передается обогреваемому аппарату 1 лучеиспусканием и конвекцией. Тепловая изоляция В уменьшает потери тепла в окружающую среду.
Электрические индукционные печи (рис. 4. 23). Нагревание в этих печах осуществляется индукционными токами. Обогреваемый аппарат 1 является сердечником соленоида 2, охватывающего аппарат; по соленоиду пропускается переменный ток, при этом вокруг соленоида возникает переменное магнитное поле, которое индуцирует в стенках обогреваемого аппарата электродвижущую силу. Под действием возникающего вторичного тока нагреваются стенки аппарата.
Соленоид выполняется из медной или алюминиевой проволоки, имеющей малое омическое сопротивление. Дуговые печи. В дуговых печах применяется нагревание электрической дугой до температур 1500 – 1300 оС. Электрическая дуга возникает в газообразной среде. В дуговых печах при возникающих больших температурных перепадах невозможны равномерный обогрев и точное регулирование температуры. Дуговые печи применяются для плавки металлов, получения карбида кальция и фосфора, для переработки бытовых отходов. 5.4.3. Охлаждение до обыкновенных температур В химической технике очень часто возникает необходимость охлаждать газы, пары и жидкости. Для их охлаждения обычно используют наиболее распространенные и доступные теплоносители — воду и воздух. Охлаждение происходит в результате теплообмена между охлаждаемой и охлаждающей средами, при этом температура охлаждающей среды должна быть ниже температуры охлаждаемой. В зависимости от времени года и климатических условий охлаждение воздухом осуществляется до 25—30° С. Водой удается охладить теплоносители до более низких температур. Обычно температуру охлаждающей воды, которая также зависит от времени года и климатических условий, принимают равной 15—25° С. Вода, отбираемая из артезианских скважин, имеет температуру 8—12° С. Охлаждение водой и воздухом осуществляется в различных теплообменниках, при этом охлаждающая и охлаждаемая среды либо разделены стенкой (если контакт между этими средами по каким-либо причинам недопустим), либо непосредственно контактируют между собой. Кожухотрубчатый теплообменник, широко распространенный в химической технологии, в котором охлаждение водой производится через стенку, показан на рис. 4.24. Охлаждающая вода вводится в нижнюю часть межтрубного пространства теплообменника и выводится из верхней. Охлаждаемый теплоноситель вводится в верхнюю часть трубного пространства и выводится из нижней. Охлаждение льдом проводят в тех случаях, когда необходимо достигнуть близкой к нулю температуры охлаждаемой жидкости. Очень часто при охлаждении лед вносится непосредственно в охлаждаемую жидкость. При этом лед нагревается жидкостью до 0° С, а затем плавится, отнимая теплоту плавления от охлаждаемой жидкости. Такой метод охлаждения применяется для жидкостей, которые не взаимодействуют с водой и для которых допускается разбавление. Время охлаждения льдом зависит от условий проведения процесса; оно уменьшается с уменьшением размеров кусков льда (вносимого в охлаждаемую жидкость) и с увеличением интенсивности перемешивания жидкости. Точный расчет времени охлаждения льдом затруднителен, поэтому время охлаждения принимают на основании опытных данных.
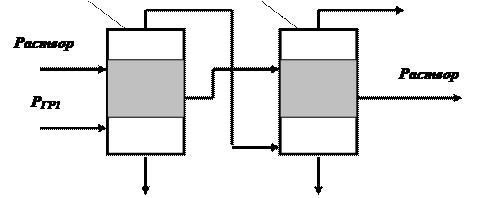
5.4.4. Конденсация Широкое распространение в химической технике имеют процессы конденсации (ожижения) паров различных веществ путем отвода от них тепла. Конденсация осуществляется в аппаратах, называемых конденсаторами. Различают два вида конденсации: 1) поверхностную (или просто конденсацию), при которой конденсирующиеся пары и охлаждающий агент разделены стенкой, и конденсация паров происходит на внутренней или внешней поверхности холодной стенки; 2) конденсацию смешением, при которой конденсирующиеся пары непосредственно соприкасаются с охлаждающим агентом. Поверхностная конденсация осуществляется в различных теплообменниках — поверхностных конденсаторах. В общем случае в поверхностный конденсатор поступает перегретый пар. Очень часто охлаждающим агентом является вода. В частности, кожухотрубчатый теплообменник, изображенный на рисунке 4.24, может быть использован и как конденсатор, когда в межтрубное пространство поступает перегретый пар. Конденсация смешением. Если конденсации подвергаются пары нерастворимых в воде жидкостей или пар, являющийся неиспользуемым отходом того или иного процесса, охлаждение и конденсацию этих паров можно проводить путем непосредственного смешения с водой в аппаратах, называемых конденсаторами смешения. Эффективность работы таких аппаратов находится в прямой зависимости от поверхности соприкосновения охлаждающей воды и пара. Поэтому поверхность соприкосновения увеличивают, распыляя охлаждающую воду при помощи различных устройств. 5. ВЫПАРИВАНИЕ 5.4.5. Выпаривание Выпаривание — процесс концентрирования растворов твердых нелетучих веществ путем удаления жидкого летучего растворителя в виде паров. Сущность выпаривания заключается в переводе растворителя в парообразное состояние и отводе полученного пара от оставшегося сконцентрированного раствора. Выпаривание обычно проводится при кипении, т. е. в условиях, когда давление пара над раствором равно давлению в рабочем объеме аппарата. Пар, образующийся над кипящим раствором, называется в технике выпаривания вторичным паром. Процесс выпаривания относится к числу широко распространенных. Последнее объясняется тем, что многие вещества, например едкий натр, едкое кали, аммиачная селитра, сульфат аммония и др., получают в виде разбавленных водных растворов, а на дальнейшую переработку и транспорт они должны поступать в виде концентрированных продуктов. Научный анализ процессов выпаривания был дан впервые в 1915 г. проф. И. А. Тищенко в монографии «Современные выпарные аппараты и их расчет»; ему же принадлежат работы, посвященные изучению свойств кипящих водных растворов. Технические процессы выпаривания растворов. В химической технике используются следующие основные способы выпаривания: простое выпаривание, проводимое как непрерывным, так и периодическим методами, многократное выпаривание, осуществляемое только непрерывно, и выпаривание с применением теплового насоса. Два последних способа проведения процесса обеспечивают значительную экономию тепла и поэтому имеют преобладающее значение. Все перечисленные процессы проводят как под давлением, так и под вакуумом, в зависимости от параметров греющего пара и свойств выпариваемых растворов. Простое выпаривание. Простое выпаривание осуществляется на установках небольшой производительности, когда экономия тепла не имеет особого значения и может проводиться как периодически, так и непрерывно. В периодическом процессе с единовременной загрузкой исходный раствор помещается в выпарной аппарат, где нагревается до температуры кипения и выпаривается. Образовавшийся вторичный пар поступает в конденсатор. Конденсат выводится из системы, упаренный раствор перекачивается в сборник готового продукта. Многократное выпаривание. Многократное выпаривание — процесс, при котором в качестве греющего используют вторичный пар и, следовательно, достигается значительная экономия тепла. Проведение подобного процесса возможно либо при использовании греющего пара высокого давления, либо при применении вакуума. Сущность многократного выпаривания состоит в том, что процесс выпаривания проводится в нескольких соединенных последовательно аппаратах, давление в которых поддерживают так, чтобы вторичный пар предыдущего аппарата мог быть использован как греющий пар в последующем аппарате. Например (рис. 4.25), вторичный пар давлением РВТ1, образовавшийся в аппарате 1, используется как греющий пар давлением РГР2 в аппарате 2 (РВТ1 ≈ РГР2,).
Рис. 4.25. Схема многократного выпаривания (прямоточная). Cопоставим прямоточную и противоточную схемы. Очевидним преимуществом прямоточной схемн является возможность перемещения раствора из корпуса в корпус без применения насосов, работающих на горячих потоках. К недостаткам прямоточной схемы можно отнести неблагоприятные для теплопередачи условия.. В [3] показано, что преимуществом противоточной схеми является меньшая поверхность нагрева, а недостатком — необходимость включення в схему насосов, работающих на горячих потоках. Недостатки прямоточних схем менее существеннн, чем противоточннх, позтому первне получили значительно большее распространение в промышленности.
4.6. Массообменные процессы Технологические процессы, скорость протекания которых определяется скоростью переноса вещества (массы) из одной фазы в другую называются массообменными процессами, а аппаратура, предназначенная для проведения этих процессов, — массообменной аппаратурой. Массообменные процессы занимают особое место среди химико-технологических процессов. В подавляющем большинстве случаев производственные установки химической промышленности создают по схеме, приведенной на рис. 4.26. Исходное сырье поступает в реактор, где лишь частично превращается в продукты реакции. Выходящая из реактора смесь продуктов реакции и непрореагировавшего сырья направляется в массообменную разделительную аппаратуру, в которой производится разделение смеси на продукты реакции и непрореагировавшее сырье. Последнее возвращается в реактор, а продукты реакции поступают на дальнейшую переработку. Из изложенного следует, что между реакционными и разделительными аппаратами существует тесная технологическая связь. Общий закон этой связи таков: чем меньше нагрузка на реакционный аппарат, т. е. чем меньше превращение исходного сырья в продукты реакции, тем больше нагрузка на разделительный агрегат, и наоборот. Очевидно, что оптимальное сочетание нагрузок на реакционный и разделительный аппараты и приводит к минимальным производственным затратам — к оптимизированному процессу. Следовательно, основа химического производства — реакционный аппарат — работает оптимально только в сочетании с оптимально работающим разделительным агрегатом и работа последнего имеет в химической промышленности не меньшее значение, чем работа самого реакционного аппарата. В разделительном агрегате могут производиться разнообразные процессы. Основными и важнейшими из них являются абсорбция, экстракция, ректификация, адсорбция и сушка. Абсорбция – избирательное поглощение газов или паров жидкими поглотителями - абсорбентами. Процесс используется во многих производствах, где из смеси газов необходимо извлечь какой-либо компонент или группу компонентов В этом процессе имеет место переход вещества или группы веществ из газовой или паровой фаз в жидкую. Экстракция [11] — извлечение растворенного в одной жидкости вещества или группы веществ другой жидкостью. Процесс используется в случаях, когда из раствора необходимо извлечь растворенное вещество или группу веществ. В этом процессе имеет место переход вещества из одной жидкой фазы в другую жидкую фазу.
 

 
Рис. 4.26. Связь реактора с разделительной аппаратурой
Ректификация — разделение жидкой смеси на чистые или обогащенные составляющие в результате противоточного взаимодействия потоков пара и жидкости. Процесс имеет большое значение в тех производствах, где необходимо частичное или полное разделение жидких однородных смесей на чистые компоненты или их группы. Очевидно, в этом процессе имеет место переход вещества из жидкой фазы в паровую, и наоборот. Адсорбция — избирательное поглощение газов, паров или растворенных в жидкостях веществ твердым поглотителем — адсорбентом, способным поглощать одно или несколько веществ из их смеси. Процесс используется во многих производствах, где из смеси газов, паров или растворенных веществ необходимо извлечение того или другого вещества. В этом процессе вещества переходят из газовой и. жидкой фаз в твердую. Сушка — удаление влаги из твердых влажных материалов путем испарения. Процесс имеет большое значение во многих производствах, где влажные природные вещества до их переработки должны предварительно обезвожены или должен быть обезвожен готовый продукт, получающийся в последней стадии производства. Нетрудно видеть, что в этом процессе имеет место переход влаги.твердого влажного материала в паровую или газовую фазу. Из приведенной краткой характеристики следует, что для всех перечисленных процессов общим является переход вещества из одной фазы в другую, или массопередача. Переход вещества из одной фазы в другую связан с явлениями конвективного переноса и молекулярной диффузии, поэтому перечисленные выше процессы получили название массообменных или диффузионных процессов. Массопередачей называют переход вещества (или нескольких веществ) из одной фазы в другую в направлении достижения равновесия. В массообмене участвуют как минимум три вещества: распределяющее вещество (или вещества), составляющее первую фазу, распределяющее вещество (или вещества), составляющее вторую фазу; распределяемое вещество (или вещества), которое переходит из одной фазы в другую (рис. 4.27). Назовем первую фазу G, вторую L, а распределяемое вещество M. Поскольку все рассматриваемые массообменные процессы обратимы, распределяемое вещество может переходить из фазы G в фазу L и наоборот, в зависимости от концентрации этого вещества в распределяющих фазах.
Рис. 4.27. Схема массобмена G – распределяющее вещество 1-ой фазы; L - распределяющее вещество 2-ой фазы; М – распределяемое вещество; Х (Y) – концентрация распределяемого вещества в фазе.L (G); Xp (Yp) – равновесная концентрация распределяемого вещества в фазе L (G)
Допустим, что распределяемое вещество находится вначале только в фазе G и имеет концентрацию Y. В фазе L в начальный момент распределяемого вещества нет и, следовательно, концентрация его в этой фазе X = 0. Если распределяющие фазы привести в соприкосновение, начнется переход распределяемого вещества из фазы G в фазу L и в последней обнаружится определенная концентрация распределяемого вещества X > 0. С момента появления вещества М в фазе L начинается и обратный переход его в фазу G, но до некоторого момента число частиц М, переходящих в единицу времени через единицу поверхности соприкосновения из фазы G в фазу L, больше, чем число частиц, переходящих из фазы L в фазу G; конечным итогом процесса является переход М из фазы G в фазу L. Через определенный промежуток времени скорости перехода распределяемого вещества из фазы G в фазу L и обратно становятся одинаковыми. Такое состояние называется равновесным. В состоянии равновесия в каждом конкретном случае существует строго определенная зависимость между концентрациями распределяемого вещества, которые при равновесии системы называются равновесными, а достигнутые концентрации – равновесными. Очевидно, что любой концентрации X соответствует равновесная концентрация Yp , и наоборот, любой концентрации Y соответствует равновесная концентрация Хр, т.е. Хр, = f1(Y) или Yp , = f2(Х) Приведенные выше функциональные зависимости определяются в каждом случае особо, чему посвящен целый ряд специальной литературы по процессам и аппаратам. Знание равновесных концентраций позволяет выяснить направление течения процесса, которое определяется стремлением к равновесию. Если Y >. Yp , и, следовательно, X < Хр, распределяемое вещество М будет переходить из фазы G в фазу L. При условии Y <. Yp (X > Хр) распределяемое вещество будет переходить из фазы L в фазу G. Так как концентрация пропорциональна числу частиц, то, следовательно, скорость перехода распределяемого вещества из одной фазы в другую пропорциональна разности между фактической концентрацией распределяемого вещества в данной фазе и равновесной концентрацией. Таким образом, движущей силой массообменных процессов являются разности концентраций (Y – Yp) и (X – Xp). 4.6.1. Абсорбция Абсорбция — поглощение газов или паров из газовых или паровых смесей жидкими поглотителями, называемыми абсорбентами. Этот процесс является избирательным и обратимым, что дает возможность применять его не только с целью получения растворов газов в жидкостях, но также и для разделения газовых или паровых смесей. В последнем случае после избирательной абсорбции одного или нескольких компонентов из газовой или паровой смеси проводят десорбцию — выделение этих компонентов из жидкости — и таким образом осуществляют разделение. Регенерированный абсорбент вновь возвращается на абсорбцию (круговой процесс). К факторам, улучшающим условия абсорбции, относятся повышенное давление и пониженная температура, а к факторам способствующим десорбции, пониженное давление и повышенная температура и прибавление к абсорбенту добавок, уменьшающих растворимость газов в жидкостях. Различают физическую абсорбцию и хемосорбцию. При физической абсорбции растворение газа не сопровождается химической реакцией. При хемосорбции абсорбируемый компонент вступает в химическую реакцию в жидкой фазе. Примерами использования процессов абсорбции в технике могут служить разделение углеводородных газов на нефтеперерабатывающих установках, получение соляной кислоты, получение аммиачной воды, очистка отходящих газов с целью улавливания ценных продуктов или обезвреживание газосбросов и другие. Аппаратурно-технологическое оформление процессов сравнительно просто, поэтому процессы абсорбции широко используются в технике. ПРИНЦИПИАЛЬНЫЕ СХЕМЫ АБСОРБЦИИ В химической технике используют следующие принципиальные семы абсорбционных процессов: прямоточные, противоточные, одноступенчатые с рециркуляцией и многоступенчатые с рециркуляцией. Прямоточная схема взаимодействия веществ в процессе абсорбции показана рис. 4.28, а. В этом случае потоки газа и абсорбента движутся параллельно друг другу; при этом газ с большей концентрацией распределяемого вещества приводится в контакт с жидкостью, имеющей меньшую концентрацию распределяемого вещества, а газ с меньшей концентрацией взаимодействует на выходе из аппарата с жидкостью, имеющей большую концентрацию распределяемого вещества.
Газ Газ
Рис. 4.28. Прямоточная и противоточная схемы абсорбции Противоточная схема показана на рис. 4.28, б.По этой схеме в одном конце аппарата приводятся в контакт газ и жидкость, имеющие большие концентрации распределенного вещества, а в противоположном конце – меньшие. Схемы с рециркуляцией предусматривают многократный возврат либо жидкости, либо газа. Многоступенчатые схемы с рециркуляцией могут включать прямой ток, противоток, рециркуляцию жидкости и рециркуляцию газа. Большое практическое значение имеет многоступенчатая противоточная схема с рециркуляцией жидкости в каждой ступени. Сопоставим рассмотренные схемы абсорбции, имея в виду следующие показатели процесса: удельный расход абсорбента и движущую силу процесса. Принимая без доказательств, которые приведены в различной специальной литературе [1, 3], отметим, что противоточный процесс обеспечивает большую конечную концентрацию поглощаемого газа в абсорбенте, а вместе с этим и меньший расход абсорбента; движущая сила при противотоке меньше, поэтому при прочих равных условиях необходимы большие размеры аппарата. Указанное соотношение носит общий характер и его можно формулировать так: изменение рабочих концентраций, приводящее к уменьшению расхода абсорбента, требует увеличения габаритов аппарата, и наоборот. 4.6.2. Ректификация Ректификация — разделение жидких однородных смесей на составляющие вещества или группы составляющих веществ в результате противоточного взаимодействия паровой смеси и жидкой смеси. Этот процесс имеет большое значение в химической технике. В качестве примеров достаточно указать на разделение природных углеводородов нефти и синтетических углеводородов с целью получения моторных топлив, на выделение индивидуальных газов из их смесей путем предварительного ожижения и последующей ректификации жидкой смеси (разделение воздуха методом глубокого охлаждения). Возможность разделения жидкой смеси на составляющие ее компоненты ректификацией обусловлена тем, что состав пара, образующегося над жидкой смесью, отличается от состава жидкой смеси в условиях равновесного состояния пара и жидкости. Известные равновесные данные для конкретной смеси позволяют проанализировать возможность разделения этой смеси, найти предельные концентрации разделения и рассчитать движущую силу процесса. ПРИНЦИП РЕКТИФИКАЦИИ Сущность процесса ректификации рассмотрим на простейшем примере разделения двухкомпонентной смеси. При ректификации (рис. 4.29) исходная смесь делится на две части: часть, обогащенную легколетучим компонентом, — дистиллят, и часть, обедненную легколетучим компонентом — остаток. Обозначим: Gf — количество смеси, поступающей на ректификацию; Gр — количество поступающего дистиллята; GW — количество получающегося остатка в; X f;, Xр, XW — содержание легколетучего компонента соответственно в исходной смеси, в дистилляте и в остатке. При принятых обозначениях схема ректификации будет иметь, представленный на рис. 4.29. Исходная смесь Gf, Xf
Дистиллят Остаток Gр, Xр GW, XW Обычно ректификационный аппарат состоит из двух частей, или ступеней — верхней и нижней, каждая из которых представляет собой любым способом организованную поверхность контакта фаз между паром и жидкостью. Сущность процесса ректификации можно характеризовать как разделение жидкой смеси на дистиллят и остаток в результате двухступенчатого взаимодействия жидкости с парами. В нижней ступени исходная, подвергаемая разделению смесь взаимодействует с паром, начальный состав которого равен составу остатка; вследствие этого из смеси извлекается легколетучий компонент. В верхней ступени пар начального состава, соответствующего составу исходной смеси, взаимодействует с жидкостью, начальный состав которой равен составу дистиллята; вследствие этого пар обогащается легколетучим компонентом до требуемого предела, менее летучий компонент извлекается из паровой фазы. Пар для питания ректификационного аппарата получается многократным испарением жидкости, имеющей тот же состав, что и остаток, а жидкость – многократной конденсацией пара, имеющего состав, одинаковый с составом дистиллята. РЕКТИФИКАЦИЯ МНОГОКОМПОНЕНТНЫХ СМЕСЕЙ. Задача разделения многокомпонентных смесей в практике встречается гораздо чаще, чем двухкомпонентных, поэтому ректификация многокомпонентных смесей является основным процессом ректификации в производствах (рис. 4.30).
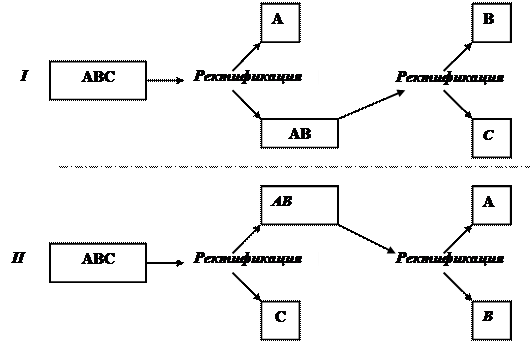
Рис. 4.30. Принципиальная схема ректификации многокомпонентной смеси. Возможные схемы разделения многокомпонентных смесей. Схема разделения на составляющие двухкомпонентных смесей однозначна, в то время как для многокомпонентных смесей представляется некоторая свобода выбора схемы разделения. Пусть смесь состоит из трех компонентов А, В и С, причем относительные летучести их аА, аВ и аС. На первый взгляд разделение указанной смеси на компоненты возможно двумя путями, показанными на рис. 4.30. Следует подчеркнуть, что первая схема разделения и аналогичные ей возможны всегда. Вторая схема и аналогичные ей возможны не всегда, и использование их ограничивается соотношением относительных летучестей компонентов и их содержанием в исходной смеси. Так, в рассмотренном примере возможность отделения смеси компонентов А и В от С имеется лишь при условии аВ > ∑аx (где ∑аx – суммарная относительная летучесть остальных двух компонентов). Иными словами, отделение в паровой фазе f -го компонента возможно только в том случае, когда его относительная летучесть аf, больше средней относительной летучести всех компонентов: ∑аx = аАxА + аВxВ + аСxС +...... Из рассмотренного примера одновременно следует, что для разделения многокомпонентных смесей непрерывным методом на п частей необходимо п — 1 ректификационных аппаратов.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 683; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.192.113 (0.011 с.) |