Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Белок-белковое взаимодействиеСодержание книги
Поиск на нашем сайте
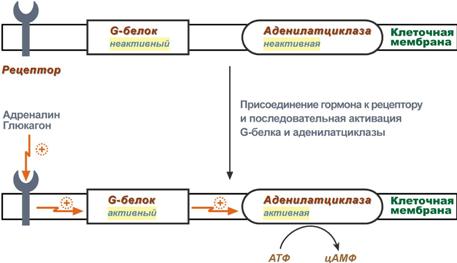
- в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент. К примеру, мембранный фермент аденилатциклаза является чувствительным к воздействию мембранного G-белка, который сам активируется при действии на клетку некоторых гормонов (например, адреналина и глюкагона).
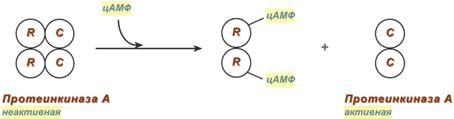
Принципиальная схема активации аденилатциклазы Другим примером белок-белкового взаимодействия может быть регуляция активности протеинкиназы А. Протеинкиназа А является тетрамерным ферментом, состоящим из 2 каталитических (С) и 2 регуляторных (R) субъединиц. Активатором для протеинкиназы А является цАМФ. Присоединение цАМФ к регуляторным субъединицам фермента вызывает их отхождение от каталитических субъединиц. Каталитические субъединицы при этом активируются.
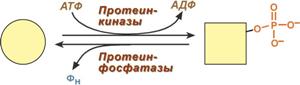
Активация протеинкиназы А при помощи цАМФ Ковалентная (химическая) модификация Ковалентная модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы.
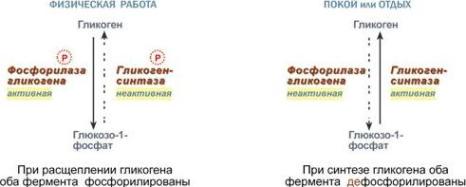
Изменение активности фермента Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, ферменты гликогенфосфорилаза и гликогенсинтаза при потребности организма в глюкозе фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена, а гликогенсинтаза неактивна. При необходимости синтеза гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной.
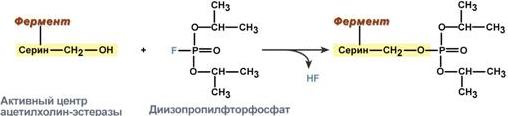
Зависимость активности ферментов обмена Лекарства обычно подавляют активность ферментов В медицине активно разрабатываются и используются соединения, изменяющие активность ферментов с целью регуляции скорости метаболических реакций и уменьшения синтеза определенных веществ в организме. Подавление активности ферментов обычно называют ингибированием, однако это не всегда корректно. Ингибитором называется вещество, вызывающее специфичное снижение активности фермента. Таким образом, неорганические кислоты и тяжелые металлы ингибиторами не являются, а являются инактиваторами, так как снижают активность любых ферментов, т.е. действуют неспецифично. Ингибирование ферментов Можно выделить два основных направления ингибирования · по прочности связывания фермента с ингибитором ингибирование бывает обратимым и необратимым. · по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное. Необратимое ингибирование При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его активности. Например, вещество диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию. Аналогичным образом действуют боевые фосфоорганические вещества (зарин, зоман) и инсектициды (карбофос, дихлофос).
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 450; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.174.253 (0.006 с.) |