Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ферменты имеют белковую природуСодержание книги
Поиск на нашем сайте
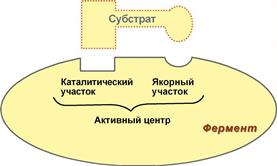
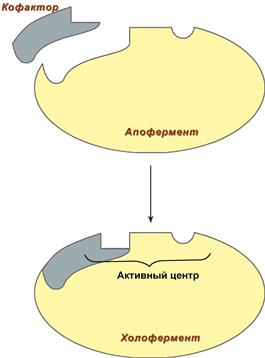
Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Поэтому подобно белкам ферменты делятся на простые и сложные. Простые ферменты состоят только из аминокислот – например, пепсин, трипсин, лизоцим. Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор. Кофактор, в свою очередь, может называться коферментом или простетической группой. Примером могут быть сукцинатдегидрогеназа (содержит ФАД) (в цикле трикарбоновых кислот), аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гем). Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении. Как многие белки, ферменты могут быть мономерами, т.е. состоят из одной субъединицы, и полимерами, состоящими из нескольких субъединиц. Структурно-функциональная организация ферментов В составе фермента выделяют области, выполняющие различную функцию: 1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. В активном центре выделяют два участка: · якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре, · каталитический – непосредственно отвечает за осуществление реакции.
Схема строения ферментов У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр. У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.
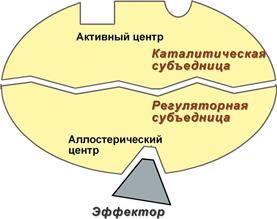
Схема формирования сложного фермента 2. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции. Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
Схема строения аллостерического фермента В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см "Регуляция активности ферментов"). Изоферменты Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента. Различные изоферменты определяют скорость и направление реакции благодаря разному сродству к субстрату. Например, димерный фермент креатинкиназа (КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы.
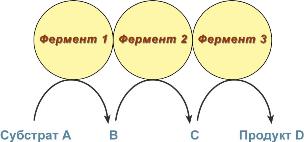
Также существует пять изоферментов лактатдегидрогеназы (роль ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2). Мультиферментные комплексы В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.
|
|||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 595; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.67.90 (0.005 с.) |

 Изоферменты креатинкиназы
Изоферменты креатинкиназы
 Изоферменты лактатдегидрогеназы
Изоферменты лактатдегидрогеназы