
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
I.2. Йодирование ацетона в нейтральной средеСодержание книги
Поиск на нашем сайте
В нейтральной среде лимитирующей является стадия (CH3)2CO ↔ СН3С(ОH)=CH2 (IV.15) Ацетон всегда содержит некоторое количество енольной формы (примерно 2,5·10–4 %) и поэтому эта стадия формально должна рассматриваться как обратимая реакция первого порядка. Но так как кето-енольное равновесие сильно смещено в сторону кетонной формы, то можно принять, что в отсутствие кислоты реакция описывается кинетикой необратимой реакции первого порядка:
Это выражение можно представить также в виде
Некаталитическая стадия йодирования ацетона протекает достаточно медленно. При комнатной температуре и небольших концентрациях ацетона (менее 0,15 моль/л) образование йодацетона, практически не наблюдается в течение нескольких часов. С увеличением концентрации ацетона и повышением температуры скорость реакции начинает увеличиваться. Поскольку константа скорости некаталитического процесса мала, то разложение экспоненты в ряд при малых значениях t позволяет применить для обработки экспериментальных данных уравнение:
По мере накопления гидроксония, являющегося катализатором данной реакции, процесс переходит в автокаталитический режим, меняется механизм процесса, а скорость заметно возрастает. Скорость реакции в этом случае описывается уравнением (IV.6), а константа скорости может быть рассчитана по уравнению (IV.12). Специфика использования этого уравнения в данном случае заключается в том, что по мере протекания некаталитического йодирования возникает пороговая концентрация водородных ионов (х 0=[H+]0), приводящая к началу каталитического процесса. При этом а >> х, а через некоторое время текущая концентрация йодацетона х становится заметно больше х 0 и тогда в удовлетворительном приближении можно записать:
Таким образом, измерение текущей концентрации йода в некаталитической реакции позволяет определить в начальный период протекания реакции константу скорости некаталитической стадии, а затем константу скорости автокаталитической стадии и пороговую концентрацию ионов [H+], приводящую к доминированию автокаталитической стадии. Следует отметить, что обе реакции (некаталитическая и каталитическая) протекают по разным механизмам (т.е. имеют разные координаты реакции), но при этом имеют одинаковые исходные вещества (ацетон и йод) и одинаковые продукты реакции (йодацетон и йодистоводородную кислоту). Поэтому экспериментальное определение констант скоростей дает возможность сравнить энергии активации, определяемые по уравнению Аррениуса
для двух механизмов одной и той же реакции.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Методика измерения Определение кинетической кривой x (t) проводят, регистрируя убыль концентрации йода, так как окраска реакционной смеси зависит от его концентрации. Для этого измеряют оптическую плотность реакционной смеси (di) через определённые (i -тые) промежутки времени на фотоколориметре при полосе поглощения света 490,6 нм. В соответствии со стехиометрическим уравнением реакции (IV.1) убыль концентрации ацетона и йода, а также концентрация образующегося йодацетона равны между собой и могут быть рассчитаны по формуле
где C 0(I2) – начальная концентрация йода в реакционной смеси. Точность последующих расчётов константы скорости реакции зависит от точности приготовления исходных растворов реагентов, измерения оптической плотности и температуры реакционной смеси. Следует обратить внимание на то, что приготовление исходной реакционной смеси и измерения оптической плотности следует проводить быстро.
Подготовка растворов. Исходные рабочие растворы готовят в колбах из кварцевого стекла, чтобы не нарушать кислотно-щелочное равновесие в растворе. Реакция в кислой среде. Для изучения кинетики реакции в кислой среде готовят рабочие растворы в соответствии с данными таблицы IV.1.
Таблица IV.1. Состав исходных растворов для изучения иодирования ацетона в кислой среде в зависимости от температуры.
Плотность ацетона при 298 К равна 0,791 г/мл.
Реакция в нейтральной среде Для изучения кинетики реакции в нейтральной среде готовят рабочие растворы в соответствии с данными таблицы IV.2. Таблица IV.2. Состав исходных растворов для изучения иодирования ацетона в нейтральной среде в зависимости от температуры.
Плотность ацетона для всех температур принять равной 0,79 г/мл
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 663; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.232.108 (0.009 с.) |

 ,
, 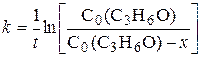 (IV.16)
(IV.16) (IV.17)
(IV.17) (IV.18)
(IV.18) (IV.19)
(IV.19) (IV.20)
(IV.20)



