
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физическая и коллоидная химияСодержание книги
Поиск на нашем сайте
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Методические материалы для студентов
Составитель: В.А.Руденок
Ижевск ФГБОУ ВПО Ижевская ГСХА
УДК 544+544.77(078) ББК 24 Ф50 Учебно-методическое пособие составлены на основе Государственного образовательного стандарта высшего образования, утвержденного 17.03.2000 г.
Рассмотрено и рекомендовано к изданию редакционно-издательским советом ФГБОУ ВПО Ижевская ГСХА, протокол №______от «____»_____________2012г.
Рецензенты: В.В.Сентемов – профессор кафедры химии Ижевской ГСХА Л.А.Грозина – кандидат химических наук, доцент кафедры химии и химической технологии ИжГТУ Составитель: В.А.Руденок – доцент кафедры химии Ижевской ГСХА
Ф 50 Физическая и коллоидная химия: задания для выполнения контрольной работы. Учебно-методическое пособие студентам, обучающимся по заочной форме обучения в Ижевской ГСХА: /сост. В.А. Руденок. – Ижевск: ФГБОУ ВПО Ижевская ГСХА, 2012. – 56 с.
В учебно-методическом пособии приводятся справочные материалы и задания для выполнения контрольной работы студентами-заочниками агрономического, зооинженерного и агроинженерного факультетов Ижевской ГСХА.
УДК 544+544.77(078) ББК 24.5+24.я73-9
© ФГБОУ ВПО Ижевская ГСХА, 2012 © Руденок В.А., составление, 2012 ОГЛОВЛЕНИЕ Ведение………………………………………………………………..….4 Методические указания по изучению дисциплины и задание для контрольной работы………………………………..………………..…..6 Физическая химия………………………………………………….........8 Коллоидная химия…………………………………………..……….....32 Приложения………………………………………… …….…………....41
ВВЕДЕНИЕ Изучение курса физической и коллоидной химии в сельскохозяйственном вузе дает теоретическую основу для понимания таких дисциплин, как физиология, микробиология, почвоведение, агрохимия, защита растений, а знакомство с физико-химическими методами исследования позволяет шире использовать их для решения некоторых вопросов сельскохозяйственного производства. Кроме того, изучение физической и коллоидной химии дает богатейший материал для формирования диалектико-материалистического мировоззрения студентов. Курс физической и коллоидной химии объединяет две дисциплины: физическую химию и коллоидную химию.
Основной формой работы студента-заочника является самостоятельная работа с книгой. Приступая к изучению курса, целесообразно вначале ознакомиться с программой. Далее следует перейти к тщательному изучению отдельных тем программы по учебнику, руководствуясь методическими указаниями. В ходе занятия нужно обязательно конспектировать отдельные формулировки и выводы уравнений, графически изображать некоторые зависимости. После изучения каждой темы необходимо ответить на вопросы для самостоятельной проверки, приведенные в методических указаниях, и решить типовые задачи. Только после этого следует приступить к выполнению контрольной работы. Зачтенные контрольные работы, исправленные в соответствии с замечаниями преподавателя, предъявляются на экзамене. Вопросы, подобные вопросам для самопроверки, являются основой экзаменационных билетов. При возникновении затруднений следует обратиться за консультацией (письменной или устной) к преподавателю. Выполненная контрольная работа должна быть выслана на кафедру химии или предъявлена лично для проверки, после чего студент допускается к собеседованию по этой работе. Только после собеседования можно получить зачет по контрольной работе. В любое удобное для вас время вы можете приехать в академию для собеседования и получения зачета. Кроме того, собеседование проводится также и в первые дни сессии. В собеседование включаются вопросы для самопроверки знаний и задачи из вашего варианта контрольной работы.
Библиографический список
Основной 1. Хмельницкий, Р.А. Физическая и коллоидная химия. – М.: Высшая школа, 1988. 2. Болдырев, А.И. Физическая и коллоидная химия. – М.: Высшая школа, 1983.
Дополнительный 3. Киреев, В. А. Курс физической химии. – М.: Химия, 1980. 4. Воюцкий, С.С. Курс коллоидной химии. – М.: Химия, 1976. 5. Захарченко, В.Н. Сборник задач и упражнений по физической и коллоидной химии. – М.: Просвещение, 1978.
Примерные затраты учебного времени при самостоятельной Работе по темам и на выполнение контрольной работы в часах Введение 1 Часть 1. Физическая химия
Часть 2. Коллоидная химия
Примерное количество времени на выполнение контрольной работы 10 часов.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ИЗУЧЕНИЮ ДИСЦИПЛИНЫ И ЗАДАНИЯ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
Методические указания, вопросы для самопроверки, которые отражают объем требований к знаниям студента, и задания для контрольной работы даны по отдельным разделам программы. К выполнению контрольного задания приступайте только после проработки всего курса по учебнику, составления конспекта курса и решения типовых задач, приведенных в методических указаниях. Каждый студент выполняет задание согласно своему варианту, определяемому по двум последним цифрам шифра. Обратите внимание на то, что данные некоторых задач представлены в обобщенных таблицах, так задачи № 1-10 имеют общее условие, которое изложено под номером 1-10. Для каждой из этих десяти задач числа для расчета нужно брать в таблице против номера задачи, соответствующей вашему варианту. В задачах не приводятся табличные данные, они помещены в приложении в соответствующих таблицах.
Таблица 1- Варианты контрольных заданий
ФИЗИЧЕСКАЯ ХИМИЯ Агрегатное состояние вещества Агрегатное состояние – важнейшая характеристика вещества. Обычно указывают агрегатное состояние при комнатной температуре, хотя большинство веществ при соответствующих изменениях температуры могут находиться в любом из агрегатных состояний. Важнейшие из параметров, определяющих агрегатное состояние – межмолекулярное взаимодействие и размеры молекул. Чем больше эти величины, тем вероятнее, что вещество будет твердым при комнатной температуре. Изучая конкретно каждое из агрегатных состояний (газообразное, жидкое, твердое), сравните их между собой по расстоянию между молекулами, возможным способам перемещения молекул и силам межмолекулярного взаимодействия. Также проведите сопоставление понятий «реальный газ» и «идеальный газ», сравнив уравнение Ван-дер-Ваальса (P+a/V2)∙(V–b)=nRT и уравнение Менделеева-Клапейрона P·V = nRT, сделав упор на физическом смысле констант уравнений Ван-дер-Ваальса; здесь Р – давление, V – объем, Т – температура (по Кельвину) газа, а и b – константы. При изучении твердого состояния обратите внимание на различие между кристаллическими и стеклообразными телами, сравните последние с жидкостями. Изучая жидкое состояние, постарайтесь уяснить физический смысл понятий поверхностное натяжение и вязкость. Изучая молекулярно-кинетическую теорию газов, обратите внимание на ее важнейший вывод, связывающий параметры уравнения состояния со средней кинетической энергией движущихся молекул. В соответствии с выводами этой теории,
PV = RT=l/3 Mu2; здесь М – масса моля газа; u2 – среднее значение квадрата скорости. Решение типовой задачи 1. Рассчитать скорость движения молекул водорода при температуре 25°С. Решение. Основным выводом молекулярно-кинетической теории газов является установление связи между величинами PV = RT и средней кинетической энергией молекул газа Мu2/2, эта связь выражается формулой:
PV=RT=2/3 Mu2/2 или RT=Mu2/2, где R – универсальная газовая постоянная Т – температура газа, °К; М – молярная масса газа (масса моля), кг; u – средняя скорость движения молекул.
Таким образом, u =
Рассчитываем значение u для молекулы водорода: по условию М = 2·10-3 кг; Т = 25 + 273 = 298 (К); R = 8,31 Дж/моль К, тогда u =
Вопросы для самопроверки 1. Назовите переходы из одного агрегатного состояния в другое. 2. Опишите явления, сопровождающие эти переходы. 3. Схематично на графике представьте изменение температуры во времени при нагревании некоторого количества вещества в области температур, где имеется плавление и кипение вещества. 4. Что такое плазма? Каковы особенности ее физических свойств? 5. Что такое уравнение состояния? Каким уравнением описывается состояние идеального газа? 6. Какие физические законы объединены в уравнении Менделеева-Клапейрона? 7. Чем отличаются реальные газы от идеальных газов? Какими уравнениями состояния описываются реальные газы? 8. Какой физический смысл имеет газовая постоянная? Каковы ее возможные размерности? 9. В чем сущность молекулярно-кинетической теории газов? 10.Что такое средняя квадратичная скорость движения молекул? Как она связана с температурой? 11. Как различается средняя скорость движения молекул различных газов при повышении молекулярной массы, если эти газы находятся при одной температуре? 12. Что такое длина свободного пробега молекулы? Какое она имеет значение для расчета скоростей химических реакций? 13. Поясните смысл таких характеристик жидкости, как поверхностное натяжение, вязкость, давление насыщенного пара. От каких собственных характеристик вещества они зависят? 14. Как измеряют поверхностное натяжение и вязкость? 15. Перечислите известные вам типы кристаллических решеток.
Вопросы для самопроверки 1. Что такое энергия? Перечислите известные вам ее виды. Сформулируйте закон сохранения энергии. 2. Что понимается под внутренней энергией термодинамической системы? Что такое энтальпия? Какова связь между внутренней энергией и энтальпией? 3. Сформулируйте первое начало термодинамики. Приведите его математическое выражение. В чем особенности тепловой энергии? 4. Сформулируйте закон Гесса. Укажите условия его применения. Как рассчитывают тепловые эффекты реакций, которые не могут быть найдены экспериментально? Какие данные для этого необходимы? 5. Укажите связь закона Гесса с первым законом термодинамики.
6. Как определяют теплоты реакций из энтальпий образования веществ? 7. Что такое параметр состояния? Какие параметры состояния термодинамической системы являются интенсивными, экстенсивными? Перечислите термодинамические параметры, применяющиеся для описания систем, в которых протекает химическая реакция (в том числе и биологических). 8. Какие процессы в термодинамике называются обратимыми; необратимыми? Приведите примеры. Как изменяется энтропия систем, в которых протекают эти процессы? 9. Что такое энтропия? Какой физический смысл имеет различие величин ΔS и ΔQ/T в случае необратимых процессов? Как может изменяться энтропия изолированной, закрытой и открытой систем? 10.Каково статистическое толкование понятия энтропия? Как изменяется энтропия в процессе жизнедеятельности и гибели живого организма как открытой системы? 11.Укажите, увеличится или уменьшится энтропия в следующих процессах: плавление льда, разложение ↔ N2O4 (N2O4 = 2NO2), получение аммиака (N2 + 3H2 = 2NH3), растворение поваренной соли в воде. Дайте объяснения на основе представлений об изменении степени упорядоченности в этих системах. 12.Сформулируйте третий закон термодинамики. Как на его основе производят вычисление абсолютных энтропии? Для чего нужны эти величины? 13. Как связана величина свободной энергии химического процесса с константой его равновесия? Каково значение этого выражения? 14. Рассмотрите, как изменяется энтропия при переходе от неживой (косной) материи к живому веществу в процессе эволюции. 15. Согласуется ли возникновение высокоорганизованной материи (жизни) со вторым законом термодинамики?
Решение типовой задачи 1. Вычислить изменение стандартной энтропии образования (ΔS°o6paз.) этанола из элементов, пользуясь табличными данными абсолютных энтропии веществ при 25 °С (стандартных энтропии веществ) S°298. Вещество S0298 Дж/к·моль С (т) графит 5,21 Н2 (г) 130,52 О2 (г) 205,18 С2Н5ОН (ж) 160,78
Решение. ΔS0образ. = ΣS0пр – ΣS0реаг. Уравнение образования этанола из элементов: 2С+ЗН2+1/202 =С2Н5ОН Подставляя величины S°298 в уравнение для данной реакции, получим с учетом коэффициентов уравнения реакции: ΔS°o6paз= 160,78– (2·5,21+3·130,52+1/2· 205,18) = –343,79 Дж/к·моль 2. Вычислите изменение энтропии при плавлении 10 г воды. Удельная теплота плавления q равна 19,12 Дж/г. Решение. Изменение энтропии для изотермического обратимого процесса можно рассчитать по формуле: ΔS = Q/T, где ΔS — изменение энтропии процесса; Q – теплота процесса; Т – температура °К. Температура плавления льда 273,16 °К. Таким образом, ΔSпл. 1 г воды найдем как ΔS = Для плавления 10 г вещества будем иметь 0,70 Дж/К·г. 3. Найти энтальпию процесса, соответствующего простейшему уравнению фотосинтеза, по величинам энтальпий образования исходных веществ и продуктов реакции. Решение. Простейшее уравнение фотосинтеза: 6СО2 + 6Н2О = С6Н12О6 = 6О2 + ΔНх Стандартные энтальпии образования веществ, участвующих в этом процессе, найдем в таблице (см. приложения). ΔН0298С6Н12О6 = - 2820,1 кДж/моль Δ Н0298СО2 = - 393,5 кДж/моль Δ Н0298 Н2О = - 241,8 кДж/моль Δ Н0298 О2, как простого вещества, равно 0 Воспользуемся для решения задачи законом Гесса. Для этого запишем термохимические уравнения всех процессов образования указанных веществ. 6С + 3О2 + 6Н2 = С6Н12О6+ΔН1 (1) С + О2 = СО2+ΔН2 (2) Н2 + 1/202 = Н2О+ΔНз (3) Умножим уравнения (2) и (3) на минус шесть и сложим почленно все эти уравнения, получим: 6С+ЗО2+6Н2—6С—6О2—6Н2—ЗО2 = C6Н12О6 + ΔH1—6СО2—6ΔН2—6Н2О—бΔНз. Произведем алгебраическое сложение: —6О2 = С6Н12О6 +ΔН1—6ΔН2—бΔНз— 6СО2—6Н2О переносим переносим вправо влево окончательно 6СО2 + 6Н2О = С6Н12О6 + 6О2 + ΔН1 -6ΔН2 – 6ΔН3 ΔНх Получим искомое уравнение фотосинтеза, из которого ясно, что ΔHx=ΔH1—6ΔН2— 6ΔНз Итак, ΔНХ = —2820,1—6(—393,5)—6(—241,8) =991,7 кДж/моль
Вопросы для самопроверки 1. Что понимается под скоростью химической реакции? Какие факторы влияют на скорость реакции? Как изменяется скорость реакции во времени? 2. Какая реакция является реакцией первого порядка? Каким уравнением она описывается? 3. Что такое период полураспада? 4. Какие реакции называются реакциями второго порядка? Каким уравнением они описываются? 5. Каков физический смысл константы скорости? От каких факторов она зависит? 6. Как влияет температура на скорость реакции? Сформулируйте правило Вант-Гоффа. 7. Почему при повышении температуры скорость реакций возрастает? Что такое энергия активации? Как и для чего ее определяют? 8. В чем сущность теории Аррениуса, описывающей влияниетемпературы на скорость реакций? 9. Что такое катализ? Катализатор? Почему катализаторы не влияют на смещение равновесия? Приведите примеры гомогенного катализа. 10. Как различные теории объясняют каталитическое действие? В чем особенности гетерогенного катализа? 11. Опишите основные особенности ферментативного катализа. Приведите примеры процессов, протекающих под действием ферментов. Сравните активность ферментов как катализаторов с активностью искусственно полученных каталитических систем. 12. Какие вещества называются ингибиторами и ретардантами? Где они применяются? 13.Приведите примеры веществ, являющихся ингибиторами нитрификации, ингибиторами окислительно-восстановительных процессов, протекающих при хранении продуктов.
Решение типовых задач 1. Период полураспада (τ) полония равен 137 дням. Найти время, в течение которого от исходного количества вещества – 0,1 г – останется 0,01 г (10%). Решение. Радиоактивный распад описывается кинетическим уравнением реакции первого порядка, т. е. или k·t = ln где к–константа скорости, t – время реакции, а – начальная концентрация или количество вещества, х – текущая концентрация, прореагировавшее количество, (а—х) – конечная концентрация. Кроме того, константа скорости связана с периодом полураспада соотношением к = 0,69/τ. Отсюда Подставим данные задачи в полученное уравнение:
t = 2. Определить энергию активации реакции разложения йодистого водорода, если известны константы скоростей при двух температурах: Кт1=8,1х10-5 при T1 = 629 °K и К т2 = 1,06х10-1 при Т2 = 781 ° К. Решение. Зависимость константы скорости от энергии активации определяется уравнением: k=kоe- где k–константа скорости при данной температуре Т, ko-константа, R-газовая постоянная, е -основание натурального логарифма, Е – энергия активации. Используя данные задачи, имеем два уравнения: k1=ko·e- Или в логарифмической форме: ln k1=ln ko- ln k2=ln ko –E/RT2 (2) Вычтем из уравнения (1) уравнение (2): ln k1-ln k2=E/RT2-E/RT1 ln отсюда 2,3 lg Подставим данные задачи и R = 8,313 Дж/к моль. Е=
Задания для контрольной работы 41–50. Что понимается под скоростью реакции? Какие факторы влияют на скорость реакции? Какая реакция называется реакцией первого порядка? Каким кинетическим уравнением она описывается? Найти количество вещества, оставшееся после протекания реакции, или время реакции по данным таблицы:
51–54. Как зависит скорость реакции от температуры? В чем сущность теории Аррениуса, описывающей влияние температуры на скорость реакции? Что такое энергия активации? Вычислите энергию активации процесса по данным таблицы.
Фотохимические реакции Вопросы для самопроверки 1. Какие реакции называются фотохимическими? Какими количественными закономерностями описываются эти процессы? 2. В чем сущность фотосинтеза? Какова роль хлорофилла в этом процессе? Из каких стадий состоит фотохимический процесс? 3. Что такое квантовый выход? 4. В чем сущность закона Гротгуса? Как количество прореагировавшего при фотосинтезе вещества зависит от мощности света и от времени облучения растения? 5. В чем сущность закона фотохимической эквивалентности Эйнштейна? Решение типовой задачи На основании анализа установлено, что сахарная свекла на 1 га в день дает привес биомассы 80 кг. Считая, что в этом количестве 30% углерода, рассчитайте, сколько литров СО2 усвоено растением и сколько кислорода при этом выделено? Решение. Задача решается в предположении, что весь углерод поступает в растение при фотосинтезе: 6СО2+6Н2О=6С6Н12О6+6О2 Рассчитаем, сколько углерода поглотилось:
Так как 1 кмоль составляет 12 кг С, то 2 кмоля – 24 кг. Из уравнения фотосинтеза следует, что 6 кмоль углекислого газа СО2 содержит 6 кмоль углерода и при его ассимиляции выделяется 6 кмоль О2. Если у нас имеется 2 кмоля С, значит столько же кмолей СО2 и О2. Из закона Авогадро следует, что 1 кмоль газа занимает объем 22,4 м3. Таким образом, было поглощено 22,4·2 = 44,8 м3 СО2 и выделилось 44,8 м3 О2,
Химическое равновесие Вопросы для самопроверки 1. Провидите вывод выражения для константы химического равновесия на основе закона действия масс. В качестве примера используйте гомогенный N2+3H2=2NH3и гетерогенный процессы С+СО2 = 2СО. 2. Каков физический смысл константы равновесия? Какие факторы влияют на величину константы равновесия? 3. Что такое обратимый процесс и необратимый процесс с термодинамической и кинетической точек зрения. 4. Что такое смещение равновесия? 5. Какие факторы влияют, и какие не влияют на положение равновесия? 6. Сформулируйте принцип Ле-Шателье. 7. Укажите, как смещается равновесие при увеличении (уменьшении) давления, температуры, концентрации исходных веществ для реакций: CO2+CaCO3+H2O(пар) CaCO3 Ca(OH)2 +CO2 CaO+ H2O(пар) 8. Как нужно изменить условия (давление, температуру, концентрацию веществ), чтобы увеличить выход аммиака в реакции 3H2+N 9. Как связана константа равновесия процесса с изменением изобарно-изотермического потенциала реакции?
Решение типовых задач 1. Вычислить равновесные концентрации водорода и йода при температуре 600°К в реакции H2 + J2=2HJ, если их начальные концентрации составляют 0,03 моль/л, а равновесная концентрация йодистого водорода равна 0,04 моль/л. Найти константу равновесия и величину изобарно-изотермического потенциала реакции при этой температуре. Решение. На образование двух молей HJ в соответствии с уравнением реакции H2+J2 =2HJ идет один моль Н2 и один моль J2, поэтому для образования 0,04 моля HJ требуется 0,02 моля Н2 и 0,02 моля J2, отсюда их равновесные концентрации составляют 0,03–0,02 = 0,01 моля. Для расчета константы равновесия после написания выражения в общем виде подставим в это выражение численные данные: К=
Далее рассчитываем изменение изобарно-изотермического потенциала этого процесса, используя связь величины ΔG и К. ΔG = – RT In K = – 2,303 RT lg К ΔG= – 2,303 • 8,313 · 600 • Ig 16 = – 2,303 • 8,313 – 600 ·1,204 = = – 13830 Дж/моль = – 13,830 кДж/моль. Итак, равновесные концентрации водорода и иода равны 0,01 моль/л, константа равновесия равна 16, величина изобарно-изотермического потенциала равна – 15,798 кДж/моль. 2. Найти константу равновесия при температуре 25 °С реакции: С2Н2 (газ.) +2Н2 (газ.) = С2Н6 (газ.), если ΔН°= - 324,2 кДж/моль и ΔS°= - 10,22 Дж/к·моль. Решение. Связь между константой равновесия в стандартных условиях и стандартным изобарно-изотермическим потенциалом реакции выражается уравнением ΔG°= – RTlnK. ΔG°= - 2,3·8,3·293·lgK (1) Стандартный изобарный потенциал связан со стандартными значениями энтальпии и энтропии реакции соотношением: ΔG°=ΔH°–TΔS° (2) Найдем величину изобарно-изотермического потенциала по уравнению (2) из данных задачи, переведя ΔН° в джоули. ΔG0 = - 324200 – 298· (- 10,22) = - 327245 Дж/моль Теперь, пользуясь найденным значением и уравнением (1), рассчитаем lg К в кДж/моль: lgK= - Используя таблицу антилогарифмов, находим значение К; К= 1,139. Растворы неэлектролитов Вопросы для самопроверки 1. Что такое раствор? В чем отличие растворов от химических соединений? 2. Рассчитайте массовую долю растворенного вещества, молярную и моляльную концентрации раствора, полученного смешением 1 г NaCl и 100г Н2O (плотность раствора примите равной 1). 3. Укажите возможные виды взаимодействия между компонентами в растворе. 4. В чем сущность физической теории растворов? В чем ее отличие от сольватной теории? 5. Что называется осмосом? Каков его механизм? Каково его биологическое значение? 6. В чем выражается аналогия между осмотическим давлением и давлением газов? 7. Какие растворы называются изотоничными, гипертоническими, гип
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 119; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.101.250 (0.017 с.) |

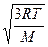
 = 1927,32 м /с.
= 1927,32 м /с. =
=  = 0,070 Дж/К·г
= 0,070 Дж/К·г =—к·х,
=—к·х, , или кt = 2,3 lg[a / (a– x) ],
, или кt = 2,3 lg[a / (a– x) ], ·t = 2,3 lg
·t = 2,3 lg  ·t = 2,3·lg
·t = 2,3·lg 
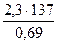 = 4,57·102 дней
= 4,57·102 дней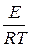 или lnk= lnko -
или lnk= lnko -  ,
,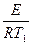 и k2=ko·e-
и k2=ko·e- 
 =E(
=E( -
-  ),
), ), E=2,3 lg
), E=2,3 lg  lg
lg  =192,8 кДж/моль.
=192,8 кДж/моль. Th
Th
 H2O+CO2
H2O+CO2

 =24 кг
=24 кг Ca(HCO3)2+Q
Ca(HCO3)2+Q =
= 




