
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Как влияет температура на различные виды поляризации ( электронную, атомную, ориентационную).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Первый закон Коновалова Первый закон Коновалова (1881 г.) описывает процесс фракционной перегонки: · насыщенный пар по сравнению с равновесным раствором обогащён компонентом, добавление которого к системе повышает общее давление пара Перегонка - испарение жидкости с последующим охлаждением и конденсацией паров. Простая перегонка — частичное испарение кипящей жидкой смеси путём непрерывного отвода и конденсации образовавшихся паров в холодильнике. Полученный конденсат называется дистиллятом, а неиспарившаяся жидкость — кубовым остатком. Фракционная перегонка (или дробная перегонка) — разделение многокомпонентных жидких смесей на отличающиеся по составу части — фракции. Основана на различии в составах многокомпонентной жидкости и образующегося из неё пара. Осуществляется путём частичного испарения легколетучих компонентов исходной смеси и последующей их конденсации. Первые (низкотемпературные) фракции полученного конденсата обогащены низкокипящими компонентами, остаток жидкой смеси — высококипящими. Для улучшения разделения фракций применяют дефлегматор
У одного из двух водных 0,005 М растворов – раствора глюкозы или раствора сульфата натрия – осмотическое давление (при одинаковой температуре) больше. Почему Величина осмотического давления, создаваемая раствором, зависит от количества, а не от химической природы растворенных в нём веществ (или ионов, если молекулы вещества диссоциируют), следовательно, осмотическое давление является коллигативным свойством раствора. Чем больше концентрация вещества в растворе, тем больше создаваемое им осмотическое давление. Это правило, носящее название закона осмотического давления, выражается простой формулой, очень похожей на некий закон идеального газа:
где i — изотонический коэффициент раствора; C — молярная концентрация раствора, выраженная через комбинацию основных единиц СИ, то есть, в моль/м3, а не в привычных моль/л; R — универсальная газовая постоянная; T — термодинамическая температура раствора. Смысл изотоничекого коэффицента: Неэлектролиты в растворе не диссоциируют, стало быть, каждая молекула неэлектролита образует в растворе лишь одну частицу. В свою очередь, электролиты в растворе под влиянием сольватации частично или полностью распадаются на ионы, образуя при этом несколько частиц на одну диссоциировавшую молекулу. Соответственно, и коллигативные свойства данного раствора (аддитивные величины) зависят от содержания в нём частиц (ионов) каждого типа из тех, которым принадлежат частицы, образовавшиеся в растворе в результате диссоциации исходной молекулы, — раствор представляется как бы смесью растворов каждого из типов частиц. Например, раствор хлорной извести содержит три типа частиц — катионы кальция, хлорид-анионы и гипохлорит-анионы. Итак, изотонический коэффициент показывает, насколько в растворе электролита больше частиц по сравнению с раствором неэлектролита аналогичной концентрации, и связан со способностью вещества распадаться в растворе на ионы, то есть, со степенью диссоциации. Если формульная единица или молекула содержит n ионов (или атомов при полярных связях, в растворе превращающихся в ионы), количество исходных молекул равно N, а степень диссоциации соединения — α, то количество диссоциировавших молекул равно N·α (при этом образуются N·α·n ионов), а общее количество частиц в растворе равно ((N — N·α) + N·α·n). Изотонический же коэффициент равен отношению:
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать для них изотонический коэффициент, равный количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент всегда меньше определённого по формуле. Например, изотонический коэффициент для 0,05-моляльного раствора NaCl равен 1,9 вместо 2,0 Таким образом, изотонический коэффициент раствора сульфата натрия больше изотонического коэффициента раствора глюкозы. Соответственно осмотическое давление раствора сульфата натрия больше осмотического давления раствора глюкозы. Образование Радикал может образоваться в результате потери одного электрона нерадикальной молекулой: · X → e− + X·+ или при получении одного электрона нерадикальной молекулой: · Y + e− → Y·− Большинство радикалов образуются в ходе химических реакций при гомолитической диссоциации связей. Они сразу же претерпевают дальнейшие превращения в более устойчивые частицы:
Как влияет температура на различные виды поляризации (электронную, атомную, ориентационную). Поляризуемость атомов, ионов и молекул, способность этих частиц приобретать дипольный момент р в электрическом поле Е. Появление р обусловлено смещением электрических зарядов в атомных системах под действием поля Е; такой индуцированный момент р исчезает при выключении поля Различают несколько видов Поляризуемость Электронная Поляризуемость обусловлена смещением в поле Е электронных оболочек относительно атомных ядер; ионная Поляризуемость (в ионных кристаллах) — смещением в противоположных направлениях разноимённых ионов из положения равновесия; атомная Поляризуемость обусловлена смещением в поле Е атомов разного типа в молекуле (она связана с несимметричным распределением в молекуле электронной плотности). Температурная зависимость этих видов Поляризуемость слабая: с ростом температуры. П оляризуемость несколько уменьшается Поляризуемость диэлектрика включает составляющие – электронную, ионную и ориентационную (дипольную). Рис.1. иллюстрирует механизм этих видов поляризуемости.
Рис. 1 Электронная поляризуемость обусловлена смещением электронной оболочки атома относительно ядра. Ионная поляризуемость вызвана смещением заряженных ионов по отношению к другим ионам. Ориентационная (дипольная) поляризуемость возникает, когда вещество состоит из молекул, обладающих постоянными электрическими дипольными моментами, которые могут более или менее свободно изменять свою ориентацию во внешнем электрическом поле. В физике твёрдых и жидких диэлектриков под поляризуемость понимают среднюю Поляризуемость (поляризацию Р, рассчитанную на 1 частицу и приходящуюся на единицу поля: a = P/EN, где N — число частиц). Поляризуемость полярных диэлектриков называется ориентационной. Поляризация диэлектриков при скачкообразных переходах его частиц из одного возможного состояния в другое под действием поля Е можно описывать, вводя релаксационную поляризуемость Характерной особенностью этих видов поляризуемость является их резкая зависимость от температуры. 28.Что называется термодинамическими параметрами системы. Приведите примеры интенсивных и экстенсивных параметров состояния.
Термодинамической системой называется совокупность материальных тел, взаимодействующих, как между собой, так и с окружающей средой. Поскольку одно и тоже тело, одно и тоже вещество при разных условиях может находится в разных состояниях, (пример: лед – вода – пар, одно вещество при разной температуре) вводятся, для удобства, характеристики состояния вещества – так называемые параметры состояния. Параметры состояния, термодинамические параметры — физические величины, характеризующие состояние термодинамической системы: температура, давление, удельный объём, намагниченность, электрическая поляризация и др. Перечислим основные параметры состояния вещества: Температура тел - определяет направление возможного самопроизвольного перехода тепла между телами. Температура, выраженная по абсолютной шкале, называется абсолютной температурой. Соотношение для перехода от градусов Цельсия к градусам Кельвина: T [K] = t [°C] + 273.15 где: T - температура в Кельвинах, t – температура в градусах Цельсия. Давление - представляет собой силу, действующею по нормали к поверхности тела и отнесенную к единице площади этой поверхности. Для измерения давления применяются различные единицы измерения. В стандартной системе измерения СИ единицей служит Паскаль (Па). Соотношение между единицами: 1 бар = 105 Па 1 кг/см2 (атмосфера) = 9.8067×104 Па 1мм рт. ст (миллиметр ртутного столба) = 133 Па 1 мм вод. ст. (миллиметр водного столба) = 9.8067 Па Плотность – отношение массы вещества к объему занимаемому эти веществом.
Удельный объем - величина обратная плотности т.е. отношения объема занятого веществом к его массе.
Различают экстенсивные параметры состояния, пропорциональные массе системы: · объём, · внутренняя энергия, · энтропия, · энтальпия, · энергия Гиббса, · энергия Гельмгольца (свободная энергия), и интенсивные параметры состояния, не зависящие от массы системы: · давление, · температура, · концентрация, · магнитная индукция и др.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 907; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.179.132 (0.009 с.) |

 ,
, .
.
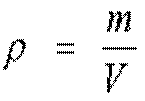
 (обратно к содержанию)
(обратно к содержанию)


