Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы построения диаграммы состояния железо-углеродСодержание книги
Поиск на нашем сайте
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПОСТРОЕНИЯ ДИАГРАММЫ СОСТОЯНИЯ ЖЕЛЕЗО-УГЛЕРОД
Диаграмма состояния (рис. 1) представляет собой графическое изображение; состояния сплавов в зависимости от температуры и концентрации компонентов. Она позволяет определить агрегатное состояние сплавов в заданном диапазоне интервалов температур и химического состава, а также компоненты, фазы и структурные составляющие в количественном и качественном отношении. Компоненты - это составляющие сплавов, имеющие свои физические и механические свойства. Компонентами черных металлов являются железо Fе и углерод С. Фазой называется однородная часть системы (сплава), имеющая свои физические и механические свойства, отделенная от других частей поверхностью раздела, при переходе через которую химический состав или структура сплава изменяются скачкообразно. Диаграмма состояния показывает устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии. Поэтому диаграмма состояния может также называться диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. В соответствии с этим и изменения в состоянии, которые отражены на диаграмме, относятся к равновесным условиям, т.е. при отсутствии перегрева или переохлаждения. Однако равновесные превращения в действительности не могут совершаться, поэтому диаграмма состояния представляет собой теоретический случай, а в практике используется для рассмотрения превращений при малых скоростях нагрева или охлаждения.
Рис.1 Диаграмма состояния железо-углерод
Общие закономерности сосуществования устойчивых фаз, отвечавших теоретическим условиям равновесия, могут быть выражены в математической форме, именуемой правилом фаз, или законом Гиббса.. Правило фаз представляет собой математическое выражение условия равновесия системы, т.е. уравнение правила фаз показывает количественную зависимость между числом степеней свободы системы і и числом компонентов k и фаз f: і=k-f+1. Следует знать, что под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, концентрация), которое можно менять без изменения числа фаз в системе. Если число степеней свободы равно нулю (нонвариантная система), то, очевидно, нельзя изменять внешние и внутренние факторы системы без того, чтобы это не вызвало изменения числа фаз. Если число степеней свободы равно единице (моновариантная система), то возможно изменение в некоторых пределах одного из перечисленных факторов, и это не вызовет уменьшения или увеличения числа фаз. Пример: Определить число степеней свободы жидкого железоуглеродистого сплава, у которого при температуре ликвидус начали выпадать первичные кристаллы аустенита. Число компонент в этом сплаве 2, т.е. железо и углерод. Число фаз тоже 2, т.е. жидкая фаза и твердая фаза кристаллов аустенита. Т.о. число степеней свободы будет определено как: і= 2-2+1=1. Из ответа следует, что в данной системе существует одна степень свободы по температуре. Т.е. двухфазное состояние может существовать от температуры начала кристаллизации до температуры окончания кристаллизации.
СТРУКТУРНЫЕ СОСТАВЛЯЮЩИЕ ЖЕЛЕЗОУГЛЕРОДИСТЫХ СПЛАВОВ
Черные металлы представляют собой сплавы из двух компонентов железа и углерода (в данной работе не учитываются примеси и легирующие добавки), железо и углерод, неограниченно растворимые в жидком состоянии, в твердом образуют два типа твердых веществ - ограниченные твердые растворы внедрения углерода в железе и химическое соединение - карбид железа. При этом первичным процессом является образование твердых растворов; карбид железа или цементит образуют атомы углерода, не растворившиеся в железе. Аллотропия железа приводит к образованию двух типов твердых растворов: высокотемпературного (аустенит) и низкотемпературного (феррит). ИЗУЧЕНИЕ ДИАГРАММЫ СОСТОЯНИЯ ЖЕЛЕЗОУГЛЕРОДИСТЫХ СПЛАВОВ Характеристика и определение линий диаграммы состояния: АВСД – линия ликвидус начало первичной кристаллизации; АHIЕСF - линия солидус - окончание первичной кристаллизации; GSE - начало вторичной кристаллизации (перекристаллизации); PSK - окончание вторичной кристаллизации для сталей и перекристаллизации для чугунов, эвтектоидная горизонталь; HIB – перитектическая горизонталь; ECF – эвтектическая горизонталь; HJB – перитектическая горизонталь; SE – линия растворимости углерода в γ -железе; PQ – линия растворимости углерода в α -железе.
Характеристика и определение основных точек диаграммы состояния: Д – температура плавления цементита (1600 0С); A– температура плавления чистого железа (1539 0С); Е –характеризует предел растворимости углерода в аустените и разделяет диаграмму на стали (левее точки Е) и чугуны (правее точки Е); S – эвтектоидная точка образования механической смеси феррита и вторичного цементита - перлита; С – эвтектическая точка образования механической смеси аустенита и первичного цементита (ледебурита) из расплава; I – перитектическая точка образования твердого раствора аустенита из феррита и жидкости; G – температура перехода α- железа в γ- железо; N – температура перехода γ- железа в δ- железо.
ПО ДИАГРАММЕ СОСТОЯНИЯ
Применение правила рычага (рис. 2) сводится к определению массовой концентрации какой-либо фазы при заданной температуре в двухфазной области диаграммы состояния. Для этого нужно через эту точку провести коноду в1в2, соединяющую линии ликвидус и солидус, и разделить длину отрезка коноды, противолежащего данной фазе, на общую длину коноды.
Пример: Определить массу Отрезки в1в0 и в0в2 – это отрезки, соответствующие массовым долям твердой Вначале определим процентное содержание твердой
Если масса сплава 1 кг, то Правила фаз гиббса
На диаграмме железо-углерод мысленно проводится вертикальная линия, и определяются температуры структурных и фазовых превращений. Для построения кривой охлаждения какого-либо сплава нужно определить является ли эта температура температурой фазового превращения. Следовательно, для каждой температуры нужно посчитать число степеней свободы і. Если і = 0, то эта температура является температурой фазового превращения и на кривой охлаждения при этой температуре следует рисовать горизонтальное плато. Длина плато зависит от массы сплава и от концентрации углерода. Если і ≠ 0, значит это температура структурного превращения и на кривой охлаждения должен наблюдаться перегиб, т.е. при этой температуре меняется скорость охлаждения. Например, построим кривую охлаждения для железоуглеродистого сплава с содержанием углерода 1%. Мысленная вертикальная линия пересекает диаграмму железо-углерод в 4 местах: при температурах Т1 =1480 Для каждой температуры посчитаем число степеней свободы і. Из правила фаз Гиббса і=k-f+1. Число компонент к = 2 (железо, углерод), 1 - число внешних воздействий (температура). Следовательно, для каждой температуры нужно посчитать число фаз f, которые находятся в равновесии при этой температуре. При Т1 в равновесии находятся жидкость и аустенит, который начал кристаллизоваться. Следовательно f= 2, і= 2-2+1=1 и на кривой охлаждения будет перегиб. При Т2 в равновесии находятся аустенит и оставшаяся жидкость. Следовательно f= 2, і= 2-2+1=1 и на кривой охлаждения будет перегиб. При Т3 в равновесии находятся аустенит и вторичный цементит, который начал выделяться при вторичной кристсллизации. Следовательно f= 2, і= 2-2+1=1 и на кривой охлаждения будет перегиб. При Т4 в равновесии находятся аустенит и вторичный цементит, а также перлит (механическая смесь феррита и цементита), который перекристаллизовывается из оставшегося аустенита. Следовательно f= 3, і= 2-3+1=0 и на кривой охлаждения будет горизонтальное плато. Теоретическая кривая охлаждения будет выглядеть следующим образом:
Рис. 5. Кривая охлаждения железоуглеродистого сплава с содержанием углерода 1%. ПРАКТИЧЕСКАЯ ЧАСТЬ
· Зарисовать в тетради часть диаграммы железо-углерод, соответствующая варианту задания (таблица). · Провести вертикальную линию на диаграмме при заданной концентрации углерода. · Определить температуры структурного или фазового превращения сплава. · Для каждой температуры посчитать число степеней свободы і. · Построить кривую охлаждения данного сплава.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что представляет собой диаграмма железо-углерод? 2. Что называется фазой и компонентом системы? 3. Приведите математическую формулировку правила фаз и закона Гиббса. 4. Назовите основные структурные составляющие железоуглеродистых сплавов. 5. Перечислите основные операции при выполнении термического анализа. 6. Что называется критической точкой диаграммы? 7. В чем сущность перитектического, эвтектического и эвтектоидного превращений? 8. Укажите порядок расчета фаз и структур при использовании правила отрезков. 9. Как зависят механические свойства углеродистой стали от изменения содержания углерода? 10. Как должны отличаться практическая и теоретическая кривые охлаждения? Контрольный тест
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПОСТРОЕНИЯ ДИАГРАММЫ СОСТОЯНИЯ ЖЕЛЕЗО-УГЛЕРОД
Диаграмма состояния (рис. 1) представляет собой графическое изображение; состояния сплавов в зависимости от температуры и концентрации компонентов. Она позволяет определить агрегатное состояние сплавов в заданном диапазоне интервалов температур и химического состава, а также компоненты, фазы и структурные составляющие в количественном и качественном отношении. Компоненты - это составляющие сплавов, имеющие свои физические и механические свойства. Компонентами черных металлов являются железо Fе и углерод С. Фазой называется однородная часть системы (сплава), имеющая свои физические и механические свойства, отделенная от других частей поверхностью раздела, при переходе через которую химический состав или структура сплава изменяются скачкообразно. Диаграмма состояния показывает устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии. Поэтому диаграмма состояния может также называться диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. В соответствии с этим и изменения в состоянии, которые отражены на диаграмме, относятся к равновесным условиям, т.е. при отсутствии перегрева или переохлаждения. Однако равновесные превращения в действительности не могут совершаться, поэтому диаграмма состояния представляет собой теоретический случай, а в практике используется для рассмотрения превращений при малых скоростях нагрева или охлаждения.
Рис.1 Диаграмма состояния железо-углерод
Общие закономерности сосуществования устойчивых фаз, отвечавших теоретическим условиям равновесия, могут быть выражены в математической форме, именуемой правилом фаз, или законом Гиббса.. Правило фаз представляет собой математическое выражение условия равновесия системы, т.е. уравнение правила фаз показывает количественную зависимость между числом степеней свободы системы і и числом компонентов k и фаз f: і=k-f+1. Следует знать, что под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, концентрация), которое можно менять без изменения числа фаз в системе. Если число степеней свободы равно нулю (нонвариантная система), то, очевидно, нельзя изменять внешние и внутренние факторы системы без того, чтобы это не вызвало изменения числа фаз. Если число степеней свободы равно единице (моновариантная система), то возможно изменение в некоторых пределах одного из перечисленных факторов, и это не вызовет уменьшения или увеличения числа фаз. Пример: Определить число степеней свободы жидкого железоуглеродистого сплава, у которого при температуре ликвидус начали выпадать первичные кристаллы аустенита. Число компонент в этом сплаве 2, т.е. железо и углерод. Число фаз тоже 2, т.е. жидкая фаза и твердая фаза кристаллов аустенита. Т.о. число степеней свободы будет определено как: і= 2-2+1=1. Из ответа следует, что в данной системе существует одна степень свободы по температуре. Т.е. двухфазное состояние может существовать от температуры начала кристаллизации до температуры окончания кристаллизации.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1055; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.143.150 (0.015 с.) |


 Рис. 2. Пример применения правила рычага (а).
Рис. 2. Пример применения правила рычага (а). твердой
твердой  -фазы для сплава с концентрацией 25%А+75%В при температуре ТВ (масса сплава 1 кг).
-фазы для сплава с концентрацией 25%А+75%В при температуре ТВ (масса сплава 1 кг). твердой фазы, надо длину отрезка, противолежащего к твердой фазе, т.е длину отрезка в0в2, разделить на длину всей коноды в1в2 и умножить на 100%. Точно так же находится массовая концентрация
твердой фазы, надо длину отрезка, противолежащего к твердой фазе, т.е длину отрезка в0в2, разделить на длину всей коноды в1в2 и умножить на 100%. Точно так же находится массовая концентрация  жидкой фазы.
жидкой фазы. ;
; 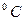 , Т2 =1330
, Т2 =1330