
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Другий початок термодинаміки.Содержание книги
Поиск на нашем сайте
Другий початок термодинаміки - фізичний принцип, який накладає обмеження на напрям процесів передачі тепла між тілами.Другий початок термодинаміки говорить, що неможливий мимовільний перехід тепла від тіла, менш нагрітого, до тіла, більш нагрітого. Другий початок термодинаміки забороняє так звані вічні двигуни другого роду, показуючи що коефіцієнт корисної дії не може дорівнювати одиниці, оскільки для кругового процесу температура холодильника не повинна дорівнювати 0. Другий початок термодинаміки є постулатом, не доводимо в рамках термодинаміки. Воно було створене на основі узагальнення дослідних фактів і отримало численні експериментальні підтвердження.
Ентропія. Третій початок термодинаміки. Ентроп́ія S — в термодинаміці міра енергії у термодинамічній системі, яка не може бути використана для виконання роботи. Вона також є мірою безладдя, присутнього в системі.
Абсолютна та відносна вологість повітря. Прилади і датчики вимірювання вологості. Абсолю́тна воло́гість повітря — густина водяної пари в повітрі; практично — кількість водяної пари в грамах в 1 м³ повітря за даної температури. Відносна вологість — відношення абсолютної вологості до її максимального значення при даній температури. При 100% відносній вологості в повітрі може відбутися конденсація водяних пар з утворенням туману, випаданням води. Температура, при якій це трапляється, називається точкою роси.RH = Pводяний пар/ Pвода x 100%
Адіабатний процес. Рівняння адіабати. Рівняння адіабати. Адіаба́тний проце́с — в термодинаміці зміна стану тіла без обміну теплом з навколишнім середовищем. Його можна здійснити, проводячи стискання чи розширення тіла (наприклад, газу) дуже швидко.
Теплові машини. Ідеальна машина Карно. Тепловий двигун – це пристрій, який перетворює внутрішню енергію палива в механічну. Енергія, яка виділяється під час згорання палива, через теплообмін передається газу. Газ, розширюючись, виконує роботу проти зовнішніх сил і приводить у рух механізм. Французький інженер С. Карно зўясував умови роботи ідеальної теплової машини. З усіх теплових машин, які працюють з нагрівником, що має температуру Тн, і холодильником, що має температуру Тх, найбільший коефіцієнт корисної дії має теплова машина, що працює за оборотним циклом Карно, який складається з двох ізотерм і двох адіабат
Фазові переходи першого і другого роду. Правило Гібса. Діаграми стану. Фа́зовий перехі́д пе́ршого ро́ду — фазовий перехід, при якому перша похідна від вільної енергії та значення інших термодинамічних потенціалів змінюється стрибком.Прикладами фазових переходів першого роду можуть бути: плавлення речовини, зрідження газу тощо. Фазови́й перехі́д дру́гого ро́ду — фазовий перехід, при якому значення термодинамічних потенціалів змінюються неперервно, а значення їхніх похідних — стрибком.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 349; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.185.202 (0.006 с.) |

 . Третій початок термодинаміки (теорема Нернста) - фізичний принцип, що визначає поведінку ентропії при наближенні температури до абсолютного нуля. Є одним з постулатів термодинаміки, прийнятою на основі узагальнення значної кількості експериментальних даних. Третій початок термодинаміки може бути сформульовано так:"Приріст ентропії при абсолютному нулі температури прагне до кінцевого межі, не залежному від того, в якому рівноважному стані знаходиться система".
. Третій початок термодинаміки (теорема Нернста) - фізичний принцип, що визначає поведінку ентропії при наближенні температури до абсолютного нуля. Є одним з постулатів термодинаміки, прийнятою на основі узагальнення значної кількості експериментальних даних. Третій початок термодинаміки може бути сформульовано так:"Приріст ентропії при абсолютному нулі температури прагне до кінцевого межі, не залежному від того, в якому рівноважному стані знаходиться система".  або
або 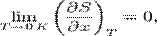 .
.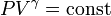 р-ня адіабати;
р-ня адіабати; 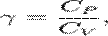 показник адіабати.
показник адіабати.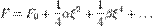 . Прáвило фаз, або правило Гіббса - співвідношення, що пов'язує кількість різних речовин (компонентів), фаз і термодинамічних ступенів свободи у гетерогенній системі (у стані термодинамічної рівноваги). Цим правилом користуються для знаходження у певному пункті фазової діаграми найвищого значення кількості термодинамічних ступенів свободи. Для рідин та газів:
. Прáвило фаз, або правило Гіббса - співвідношення, що пов'язує кількість різних речовин (компонентів), фаз і термодинамічних ступенів свободи у гетерогенній системі (у стані термодинамічної рівноваги). Цим правилом користуються для знаходження у певному пункті фазової діаграми найвищого значення кількості термодинамічних ступенів свободи. Для рідин та газів:  Для твердої речовини:
Для твердої речовини: 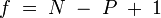 . Діаграми стану, або діаграми фазової рівноваги в зручній графічній формі показують фазовий склад сплаву в залежності від температури і концентрації. Діаграми стану будують для умов рівноваги (остаточне стан).
. Діаграми стану, або діаграми фазової рівноваги в зручній графічній формі показують фазовий склад сплаву в залежності від температури і концентрації. Діаграми стану будують для умов рівноваги (остаточне стан).


