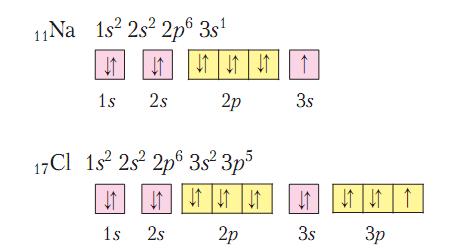Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общее представление о неметаллах. Галогены. Хлор и его соединения.Содержание книги
Поиск на нашем сайте
План. 1) Общее представление о неметаллах. Инертные газы. 2) Особенности строения атомов галогенов, характерные валентности и степени окисления. 3) Особенности физических свойств 4) Нахождение в природе 5) Получение 6) Применение 7) Соединения хлора, их свойства и применение.
1. Общее представление о неметаллах. Все неметаллы относятся к р-элементам (кроме s-элементов водорода и гелия) и имеют наполовину или более заполненный внешний электронный слой (бор имеет три электрона, это исключение). Они обладают достаточно высокой ЭО и могут завершать внешний электронный слой за счет чужих электронов, т.е. у них в отличии от металлов может быть отрицательная степень окисления. Неметаллы имеют или атомную кристаллическую решетку или молекулярную, связь – ковалентная неполярная. Если решетка атомная, то это очень тугоплавкие и нерастворимые ни в чем вещества. Таких веществ очень немного. А если молекулярная – то агрегатное состояние может быть разное, но температура плавления невысокая. Неметаллы имеют разнообразную окраску, разную плотность, в воде обычно плохо растворимы или практически не растворимы. Среди неметаллов особое положение занимают инертные газы. Так называют элементы восьмой главной подгруппы. Они имеют завершенный внешний слой и не желают его терять, т.е. в химические реакции либо вступают при очень жестких условиях (ксенон, криптон, аргон) либо вообще не вступают (гелий и неон). Эти газообразные вещества существуют в виде отдельных атомов, имеют очень низкую температуру кипения. В небольшом количестве инертные газы входят в состав атмосферы и используются в технике в основном именно благодаря своей химической инертности. 2. Элементы – F, Cl, Br и I носят общее название галогенов (рождающие соли). К ним же следует отнести и элемент № 85 – астат (At). Как видно из приводимых электронных структур, атомы галогенов имеют 7 электронов во внешнем слое.
Основываясь на этом, можно наметить некоторые черты их химической характеристики: так как до устойчивой конфигурации внешнего слоя не хватает лишь по одному электрону, они обладают очень высокой ЭО, наиболее типичными для галогенов должны быть соединения с металлами и водородом, в которых они имеют степень окисления (-1) и одновалентны. Для фтора это единственно возможная степень окисления, т.к. он имеет максимальную электроотрицательность среди элементов, а значит никому свои электроны никогда не отдает. С другой стороны, у остальных галогенов (хлора, брома и иода) максимальная положительная степень окисления (+7), возможны и более низкие: +1, +3, +5. и валентность можно ожидать равной не только I, но и III, V, VII. Окислительные свойства уменьшаются сверху вниз, т.к. увеличивается радиус атомов и ЭО тоже уменьшается.
2. Простые вещества,образованные элементами – галогенами имеют молекулярную кристаллическую решетку. Их молекулы двухатомны. Все галогены летучи и обладают резким запахом, ядовиты. В качестве средства первой помощи при острых отравлениях ими применяется вдыхание паров смеси спирта с эфиром. Полезно также вдыхание паров нашатырного спирта.
формула молекулярная масса агрегатное состояние и цвет температура плавления температура кипения F2 газ бесцветный - 218 -187 Cl2 газ желто-зеленый -101 -34 Br2 жидкость красно-бурая -6 I2 кристаллы черно-фиолетовые Иод при нагревании обычно не плавится, а возгоняется. Так называют переход вещества из твердого состояния в газообразное. Фтор и хлор тяжелее воздуха, плотность брома равна 3,1, иода – 4,9. Один объем воды растворяет около двух объемов хлора (или 0,7 г). Образующийся раствор часто называют «хлорной водой». Растворимость брома в воде составляет около 3,5 г, а иода–0,03 г на литр. Галогены гораздо лучше растворяются в различных органических растворителях, чем в воде.
|
|||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 10; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.103.19 (0.01 с.) |

 4) Особенности химических свойств (на примере хлора)
4) Особенности химических свойств (на примере хлора)