
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Структура периодической системы (ПС) химических элементов Д.И. МенделееваСодержание книги
Поиск на нашем сайте
Занятие 3,4 Тема «Периодический закон и периодическая система в свете представлений 1) Строение атома. В конце ХІХ – начале ХХ века было установлено, что атомы имеют сложное строение. Исследования английского физика Э. Резерфорда привели к созданию в 1913 году ядерной модели атома, согласно которой в центре каждого атома находится очень малое по размерам положительно заряженное ядро, а вокруг ядра движутся отрицательно заряженные частицы – электроны. В 30-х годах ХХ века были открыты частицы, которые входят в состав атомных ядер и поэтому названные нуклонами(«nucleus» - ядро). Этими частицами являются протоны и нейтроны. Таким образом, атомы состоят из протонов, нейтронов и электронов. Их общее название- элементарные частицы. Сведения об элементарных частицах приведены в таблице: Название Символ Заряд Абсолютная масса (кг) Относит. масса Протон 11р +1 1,673 · 10-27 1,007 ~ 1 Нейтрон 10n 0 1,675 · 10-27 1,009 ~ 1 Электрон еˉ -1 9,11 · 10-31 ~1/1840
Как видно из этой таблицы, масса протона примерно равна массе нейтрона и приблизительно в 1840 раз больше массы электрона. Отсюда выводы: А) Практически вся масса атома сконцентрирована в его ядре. Б) Массой электронов можно пренебречь. Поскольку относительные массы протона и нейтрона равны 1, масса атома равна сумме числа протонов и нейтронов. Это сумма называется массовым числом атома А: А = Где Z – число протонов, N – число нейтронов. Так как заряд протона равен +1, число протонов Z равно заряду ядра атома. Атом является электронейтральной частицей, поэтому число электронов должно быть равно числу протонов, т.е. заряду ядра. Заряд ядра = Число протонов = Число электронов Порядковый номер в ПС = В 1914 году английский физик Г.Мозли установил, что заряд ядра атома данного элемента равен его порядковому номеру в периодической системе элементов, созданной Д.И.Менделеевым еще в 1869 году. Существуют атомы одного элемента, содержащие разное число нейтронов, а значит, имеющие разные массовые числа. Атомы одного элемента, имеющие разные массовые числа, называются изотопами. Для обозначения изотопа слева от символа элемента внизу записывают величину заряда ядра Z, а вверху – массовое число А. Например, 3517Сl – изотоп хлора с массовым числом 35 (хлор – 35). Иногда в символе изотопа указывают только массовое число : 35Сl. Разные элементы существуют в виде разного числа изотопов, содержание каждого изотопа в природе различно. Например, хлор существует в природе в виде двух изотопов: 75,77% изотопа 35Сl и 24,23% изотопа 37Сl. В химических расчетах используются относительные атомные массы, представляющие собой средние значения массовых чисел с учетом их процентного содержания в природе. Например, для хлора: Аr(Cl) = 35 · 0,7577 + 37 · 0,2423 = 35,5. То есть, существованием изотопов объясняются дробные значения Аr практически у всех химических элементов. Строение электронной оболочки атома Совокупность электронов в атоме представляет собой его электронную оболочку. Электронная оболочка любого атома делится на энергетические уровни (1, 2, 3-й и т.д.). Уровни делятся на подуровни (обозначаются буквами s, p, d, f).
Первый энергетический уровень состоит из одного подуровня s
Второй энергетический уровень состоит из двух подуровней : s и р
Третий энергетический уровень состоит из трех подуровней: s p d S
p
d
f
Четвертый энергетический уровень состоит из четырех подуровней: Подуровни состоят из атомных орбиталей. s-подуровень имеет форму шара; р-подуровень имеет форму правильной восьмерки; d-подуровень – четырехлистника; f – более сложную форму. Атомная орбиталь – это часть атомного пространства, в которой вероятность нахождения электрона составляет приблизительно 90%. Орбитали обозначаются как 1s (орбиталь 1-го уровня, s – подуровня), 2s, 2р, 3s, 3р, 3d, 4s…число орбиталей в подуровнях: Подуровень s р d f Число орбиталей 1 3 5 7 Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями: 1) Принцип минимума энергии: меньше Электроны заполняют орбитали, начиная с подуровня с меньшей энергией. Последовательность нарастания энергии подуровней: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s 2) Правило запрета ( принцип Паули): В каждой орбитали может разместиться не более двух электронов. Один электрон на орбитали называется неспаренным , два электрона – электронной парой:
Пустая орбиталь ↑
↓
Орбитали с неспаренными электронами или ↑↓
Орбиталь с электронной парой 3) Правило Хунда: В пределах подуровня электроны сначала заполняют все орбитали наполовину, а затем – полностью. Распределение электронов в атоме по энергетическим уровням, подуровням, атомным орбиталям отображают с помощью электронных формул. Например электронная формула 1s2 отображает, что на первом уровне s – подуровне находятся два электрона Максимальное число электронов ( N) на уровне высчитывают по формуле: N = 2n2 где n – номер энергетического уровня Т.е. на первом энергетическом уровне максимально может быть 2 · 12 = 2 т.е. два электрона. На втором энергетическом уровне максимально может быть 2 · 22 = 8 т.е. восемь электрона. На третьем уровне максимально может быть 2·32=18 т.е.восемнадцать электронов. На четвертом энергетическом уровне максимально может быть 2 · 42 = 32 т.е. тридцать два электрона. Так как s – подуровень состоит из одной атомной орбитали, то в соответствии с принципом Паули, максимально на s – подуровне может находиться два электрона. р – подуровень состоит из трех атомных орбиталей, следовательно, на нем максимально может быть 2 · 3 = 6 шесть электронов. d – подуровень состоит из пяти орбиталей, следовательно, на нем максимально может быть 2 · 5 = 10 десять электронов. f – подуровень состоит из семи атомных орбиталей, на которых максимально располагаются 2 · 7 = 14 четырнадцать электронов. Заполнение электронами атомных орбиталей у элементов главных подгрупп происходит на внешнем энергетическом уровне, электроны которого являются валентными ( способными образовывать химические связи). Пример 1: Составьте электронные формулы атома элемента с порядковым номером 16. Покажите распределение электронов по атомным орбиталям графически. Так как число электронов в атоме равно его порядковому номеру в ПС, то для элемента №16 (сера) электронная формула имеет вид:
S +16 1s22s22р63s23р4 (на внешнем, третьем, уровне серы шесть электронов, 2 8 6 следовательно, высшая степень окисления серы +6). Электронную формулу можно представить графическив виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей (АО).
3s 3p 3d
↓↑
↓↑
↓ ↓
2s 2p
↓↑
↓↑
↓↑
↓↑
1s ↓↑
Пустой 3d – подуровень в графической формуле можно не изображать:
3s 3p
↓↑
↓↑
↓ ↓
2s 2p
↓↑
↓↑
↓↑
↓↑
1s ↓↑
Как видно, графическая формула показывает число неспаренных электронов.Последний (16 – ый) электрон занимает р – подуровень, следовательно, сера принадлежит к семейству р – элементов. Заполнение электронами атомных орбиталей у элементов побочных подгрупп происходит как на внешнем энергетическом уровне, так и на d – подуровне предвнешнего уровня; электроны, находящиеся на них являются валентными. У элементов побочных подгрупп на внешнем уровне всегда два электрона. Исключение составляют Сr и Сu, у которых на внешнем энергетическом уровне один электрон, наблюдается «провал» электрона. Пример 2: Составьте электронные формулы атома элемента с порядковым номером 25. Покажите распределение электронов по орбиталям графически только на валентных уровнях.
Мn +25 1s22s22р63s23р64s23d5 (на валентных уровнях марганца 2 8 13 2 семь электронов, высшая степень окисления +7 соответствует
↓↑
↓
↓
↓
↓
↓
номеру группы Ѵll). Покажем распределение электронов по атомным орбиталям графически на валентных уровнях: . . . Последний, 25-ый электрон, размещается на d-подуровне, следовательно, Мn относится к семейству d-элементов.
Элементы, объединенные в одном и том же вертикальном столбце ПС, составляют группуэлементов. Группа обозначается римской цифрой ( от I до Ѵlll). Группы делятся на главные и побочные. Последние состоят из элементов только больших периодов (lѴ,Ѵ,Ѵl). Главные подгруппы включают элементы как больших, так и малых периодов (l ,ll lll). № группы - 8 Номер группы соответствует высшей степени окисления элемента. Низшая степень окисления определяется по правилу:
Например, азот N находится в Ѵ группе. Следовательно, его высшая степень окисления +5, низшая -3. Хлор Сl – элемент Ѵll группы, его высшая степень окисления +7, низшая -1. В главных подгруппах с ростом порядковых номеров элементов усиливаются металлические свойства ( способность атома отдавать электроны) образуемых ими простых веществ и ослабевают неметаллические свойства ( способность атома принимать электроны); усиливается основный характер оксидов и гидроксидов. Последовательность элементов, построенная по возрастанию их порядковых номеров, начинающаяся щелочным металлом и заканчивающаяся инертным газом, представляет собой период. Период обозначается арабской цифрой ( от 1 до 7). Номер периода указывает общее число энергетических уровней в атоме данного элемента и одновременно номер заполняемого уровня. Химические свойства элементов и образованных ими веществ по периоду закономерно изменяются: 1. Металлические свойства простых веществ, наиболее ярко выраженные у щелочных металлов, ослабевают и сменяются неметаллическими, которые наиболее ярко выражены у галогенов. 2. Значение высшей степени окисления возрастает от +1 до +7. 3. Основные оксиды элементов начала периода сменяет амфотерный оксид и далее – кислотные, свойства которых усиливаются: Nа2О → МgО → Аl2О3 → SiО2 → Р2О5 → SО3 → Сl2О7 Основные оксиды амфотерный оксид кислотные оксиды 4.Гидроксиды – основания через амфотерный гидроксид сменяются все более сильными кислотами: NаОН → Мg(ОН)2 → Аl(ОН)3 → Н2SiО3 → Н3РО4 → Н2SО4 → НСlО4 Щелочь основание амфотерный слабая кислота средней сильная очень сильная гидроксид кислота силы кислота кислота При переходе к новому периоду свойства элементов изменяются аналогичным образом. На основании этих наблюдений Д.И.Менделеев сформулировал Периодический закон, который в соответствии с принятой в настоящее время терминологией звучит так: Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от их относительных атомных масс. Открытие изотопов позволило дать другое, современное определение Периодического закона:
|
||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 49; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.011 с.) |

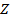 + N,
+ N,


