Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Титриметричний аналіз, його сутність. Вимоги до реакцій і реактивів, що використовуються у титриметричних методах аналізу. Титр та титр за речовиною, яку визначаютьСодержание книги
Поиск на нашем сайте
У титриметричному аналізі вимірюють об'єм робочого розчину (розчину реактиву відомої концентрації), який витрачено на взаємодію з розчином визначуваної речовини. За об’ємом і точною концентрацією робочого розчину розраховують кількість або масу речовини, яку визначають. Речовину, яку визначають, називають "аналіт", а розчин реактиву відомої концентрації, який використовують для титрування, називається робочим, або титрованим, розчином. Процес додавання робочого (титрованого) розчину до розчину визначуваної речовини називається титруванням. Титрують до того моменту, поки буде досягнута точка еквівалентності (кінець реакції). Точку еквівалентності звичайно встановлюють, вводячи в розчин відповідний індикатор. Залежно від типу хімічної реакції методи титриметричного аналізу поділяються на такі групи: - методи нейтралізації (кислотно-основного титрування); - методи осаджувального титрування; - методи комплексоутворення; - методи окислення-відновлення. Хімічні реакції в титриметричному аналізі повинні відповідати певним вимогам, а саме: 1. Реакції повинні проходити стехіометрично, тобто згідно з рівнянням реакції. 2. Робочий розчин реактиву повинен реагувати тільки з тією речовиною, яку треба визначити ( на повинно бути побічних реакцій). 3. Реакція між робочим розчином і розчином визначуваної речовини повинна проходити швидко. Ця умова в більшості випадків виконується, тому що в титриметричному аналізі використовуються головним чином іонні реакції, швидкість яких досить значна. Іноді все-таки трапляється, що певна речовина повільно реагує з робочим розчином. Якщо ж є потреба у визначенні, з використанням повільної реакції, то застосовують зворотне титрування. Приготування робочих (титрованих) розчинів є однією з найвідповідальніших операцій титриметричного аналізу. Правильне приготування і встановлення концентрації цих розчинів є необхідною умовою для одержання точних результатів аналізу. Найпростішим і найточнішим способом приготування розчинів відомої концентрації є зважування потрібної кількості препарату і розчинення взятої наважки в певному об'ємі. Але більшість речовин, які використовують для приготування робочих розчинів містять домішки, частково розкладаються або окислюються у розчині. Тому точну концентрацію робочих розчинів у більшості випадків визначають методом титрування вихідних речовин або розчинів, що мають точно відому концентрацію. Далеко не всі препарати можуть використовуватись як вихідні речовини. Розглянемо докладно вимоги, яким повинні відповідати вихідні речовини. - Першою і найбільш важливою вимогою є відповідність реального складу речовини її хімічній формулі. - Друга важлива вимога до вихідних речовин полягає в тому, що їх розчини повинні бути стійкими і концентрація таких розчинів не повинна змінюватись при зберіганні. - Вихідна речовина повинна повністю реагувати з робочим розчином у відповідності з рівнянням реакції. - Нарешті, бажано, щоб вихідні речовини мали велику молярну масу еквівалента. У цьому випадку доводиться брати досить велику наважку препарату, внаслідок чого зменшується відносна похибка, пов'язана з неточністю зважування. Існує порівняно невелика кількість хімічних сполук, які повністю відповідають усім переліченим вище вимогам. До них належать, наприклад, такі речовини, як дихромат калію, оксалат калію та деякі інші, які вказуються у наступних розділах.
На перших етапах розвитку титриметричного аналізу як одиницю концентрації робочих розчинів використовували титр, тобто кількість грамів речовини в 1мл розчину. Легко побачити, що між титром і нормальністю розчину (молярною концентрацією еквівалента) існує проста залежність:
Тепер титр рідко застосовують для позначення концентрації робочих розчинів, тому що вести розрахунки через молярну концентрацію еквівалента (нормальність) простіше. Але у фармацевтичній практиці, де виконується багато однотипних аналізів, використовують титр робочого розчину за визначуваною речовиною ( скільки грамів визначуваної речовини відповідає 1 мл робочого розчину). Приклад: Для обчислення маси визначуваної за результатами титрування речовини треба помножити титр на об'єм робочого розчину, витраченого на титрування, наприклад:
|
||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 5; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.104.175 (0.006 с.) |

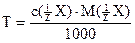
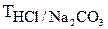 .
.