
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Введение. Что такое овр. . Вычисления степеней окисленияСодержание книги
Поиск на нашем сайте
1. ВВЕДЕНИЕ
Окислительно - восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют большое значение в теории и практике. При анализе лекарственных средств, как и многих других веществ, используются количественные методы, в основе которых лежат окислительно-восстановительные реакции (ОВР). Это методы перманганатометрии, йодометрии, броматометрии и др. Вот некоторые реакции, которые лежат в основе этих методов или используются для определения содержания количества веществ:
- метод перманганатометрии:
а) 5H2C2O4 + 2KM n O4 + 3 H2SO4 à 2 MnSO4 +K2SO4 +3H 2O
б) 5H2O2 + 2KM n O4 + 3 H2SO4 à 2 MnSO4 +K2SO4 + 5О2 +8H 2O
- метод иодометрии:
в) 2 Na2S 2O3 + I2 à 2 NaI + Na2S4O6 тетратионат натрия г) K2Cr2O7 + 6 KI + 7H2SO4 à Cr2(SO4)3 + 4 K2SO4 + 3I2 + 7 H2O
- метод броматометрии:
д) KBrO3 + 6KI + 6HCl à KBr + 6KCl + 3I2 + 3 H2O
е) KBrO3 + 5KBr + 6HCl à 6KCl + 3Br2 + 3 H2O
- метод нитритометрии:
ж) 2HNO2 + 2HI→ I2 +2NO + 2H2O
Окисление-восстановление - один из важнейших процессов природы. С ним связаны дыхание и обмен веществ, гниение и брожение, фотосинтез, нервная деятельность человека и животных. Их можно наблюдать при сгорании топлива, в процессе коррозии метaллов и при электролизе. Они лежат в основе металлургических процессов и круговорота веществ в природе; с их помощью получают кислоты, щелочи и многие другие ценные продукты. Реакции окисления-восстановления лежат и в основе многих методов лабораторной диагностики. Вы в своей будущей учебе и работе будете постоянно встречаться с ОВР, начиная с мытья лабораторной посуды и кончая проведением самых различных видов анализа. Что такое ОВР? Все многообразие химических реакций можно разделить на 2 типа: 1. Реакции, протекающие без изменения степени окисления атомов элементов, входящих в состав реагирующих веществ.
Например: +1 -1 +1 +5 -2 +1 -1 +1+5 -2 KCl + АgNОз = AgCl + КNОз
+4 -2 +2 -2 +4 -2 МgСОз = MgO + СО2
2. Реакции, сопровождающиеся изменением степени окисления атомов элементов, входящих в состав реагирующих веществ. Например:
0 +2 +6 -2 +2 +6 -2 0
Fе + CuSO4 = FeS О4 + Си
-3 +1 +3 -2 0 +1 -2 NH4 NO2 = N2 + 2H 2 O
Сравните степени окисления подчеркнутых элементов.
Реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, называются окислительно- восстановительными.
С современной точки зрения: изменение степени окисления связано с оттягиванием или перемещением электронов. Поэтому, наряду с приведенным выше определением, можно дать такое определение ОВР:
окислительно-восстановительныминазываются реакции, в которых происходит переход электронов от одних атомов, молекул, ионов к другим.
Задание для самоконтроля № 1: Среди приведенных ниже уравнений выберите уравнения ОВР. 1) Zп(ОН)2 + 2NaOH= Na2 ZnО2 + 2Н2 О 2) 4НNОз + Сu = Сu(NО)2 + 2NО2 + 2Н2 О 3) Fe + 2НСI = FeСI2 + Н2 4) СаСОз = СаО + СО2 5) MnО2 + HCl = Cl2 + МnC12 + Н2 О
Если Вы забыли... что такое степень окисления и как ее найти: степень окисления характеризует состояние атома в молекуле; степень окисления - это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов. Или … - это условный заряд, который приобретает атом при условии полного смещения пары электронов ковалентной связи к более электроотрицательному атому. Степень окисления может принимать отрицательное значение, если атом принял электроны (-1, -2 и т.д.); - положительное значение, если атом отдал электроны (+1, +2 и т.д.) - нулевое значение, если смещения не произошло и электронные пары, в равной мере принадлежат обоим атомам (обычно нулевая степень окисления присуща простым веществам - Н2, Р4, Fe, Na, S, O2 с ковалентной неполярной связью или металлической - Fe, Na и др.).
1. Степень окисления (C.О.) кислорода в большинстве соединений равна -2 за исключением пероксидов (Н2О2) и дифторида кислорода (OF2) . С.О. в них равна -1 и +2, соотвтственно. 2. С.О. водорода равна +1 за исключением гидридов металлов (NaH, CaH2 и др. С.О.= -1). 3. Алгебраическая сумма степеней окисления в молекуле всегда равна 0, а в сложном ионе - заряду иона. 4. Степень окисления элемента в простых веществах принимается за 0.
Алгоритм вычисления степени окисления в бинарной (состоящей из двух химических элементов) молекуле: пример: MnO2
Записываем формулу вещества MnO2 Ставим известную степень окисления над химическим элементом, а неизвестную степень окисления обозначаем через Х х -2 MnO2 Алгебраическая сумма степеней окисления в молекуле равна 0 (т.е., молекула заряда не имеет) х -2 (MnO2) 0 Cоставляем уравнение х + (-2)∙ 2 = 0 Решаем уравнение х - 4 = 0; х = +4
Вывод: степень окисления марганца в MnO2 равна + 4. · В оксидах с нечетным числом атомов кислорода степень окисления элемента (если произвести расчет) равна этому нечетному числу («перекрестное» правило) со знаком + : х -2 Э2О3
Э2О3 2∙х = - [3 ∙ (-2)]
- [3 ∙ (-2)]
2 Алгоритм вычисления степени окисления в сложной молекуле: пример: H2Cr2O7 Записываем формулу вещества H2Cr2O7
Ставим известные степени окисления над химическими элементами, а неизвестную степень окисления обозначаем через Х +1 х -2 H2Cr2O7
Алгебраическая сумма степеней окисления в молекуле равна 0 (т.е.,
молекула заряда не имеет) +1 х -2 (H2Cr2O7)0
Cоставляем уравнение (+1) ∙ 2 + х ∙ 2 + (-2)∙ 7 = 0 Решаем уравнение 2+2х -14 = 0 2х = 14-2; 2х = 12; х = +6
Вывод: степень окисления хрома в хромовой кислоте равна +6.
Алгоритм вычисления степени окисления в сложном ионе: пример: РO43-
Записываем формулу иона РO43-
Ставим известные степени окисления над химическими элементами, а неизвестную степень окисления обозначаем через х х -2 Р O43- Алгебраическая сумма степеней окисления в ионе равна заряду иона
-3
Cоставляем уравнение х + (-2) ∙ 4 = -3 Решаем уравнение х = +8-3 = +5
Вывод: степень окисления фосфора в ортофосфат - ионе равна +5.
• Если вы вычислили степень элемента в составе сложного аниона или сложного катиона один раз, а этот ион встречается в уравнении повторно, например H3PO4 и Ca3(PO4)2 , то степень окисления у фосфора будет та же самая +5.
|
|||||||
|
Последнее изменение этой страницы: 2024-06-17; просмотров: 9; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.132.164 (0.011 с.) |

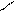
 х -2
х -2  х = = +3
х = = +3


