Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Патогенез и клинические признаки
Род Cryptosporidium выделяется. Очень низкой видоспецифичностью, а также Лёгкостью межвидового перезаражения. Животное инвазируется либо путём прямого контакта, либо непрямым путём через предметы, контаминированные ооцистами, а иногда обоими путями. [4, 3 ] Симптомы и течение. Паразиты вызывают воспаление кишечника. При этом болезнь протекает остро. У больных животных наблюдают понос, они отказываются от корма, худеют, особенно тяжело болезнь протекает у животных с иммунным дефицитом. До 50-60% заболевшего молодняка гибнет. [5] Диагностика заболевания. Обнаружение криптоспоридий в мазках фекалий. Для мазков используют хорошо обезжиренные предметные стекла, ¼ часть которых зашлифована и предназначена для маркировки препарата простым карандашом. Если фекалии жидкие, то делают мазки без применения физиологического раствора. Небольшое количество фекалий (на кончике скальпеля) помещают на предметное стекло и делают тонкий мазок стеклянной палочкой или круговыми движениями скальпеля. Если фекалии густые – на предметное стекло наносят каплю физраствора, смешивают с небольшим комочком фекалий и приготавливают мазок. Мазок высушивают на воздухе. Фиксацию мазков проводят метанолом, этанолом или смесью Никифорова – 8-10 минут. Мазок высушивают при комнатной температуре. Окрашивание мазков проводят по методу Циль-Нильсена. Учет результатов: на синем фоне четко выделяются округлые ярко-красные с различным оттенком ооцисты криптоспоридий. Вместо синьки Лефлера можно использовать 0,5%-ный раствор малахитового зеленого или 1%-ный раствор бриллиантового зеленого, приготовленных на воде или 100 спирте. В первом варианте докрашивание проводят в течение 3 мин., а во втором до 30 секунд. Учет результатов: на зеленом фоне четко выделяются красные ооцисты. В красный цвет окрашиваются некоторые микробы, споры грибов и жироподобные вещества, но они отличаются от ооцист криптоспоридий размерами, формой и отсутствием внутри структурных образований. Флотационные методы используют для концентрации ооцист криптоспоридий при исследовании фекалий животных. Для этого используют насыщенные растворы поваренной соли или аммиачной селитры. Приготовление раствора: 450 г поваренной соли при подогревании растворяют в 1000 мл водопроводной воды. После остывания, раствор фильтруют и определяют его плотность с помощью денсиметра, которая должна быть 1,2.
Для приготовления насыщенного раствора на 1 л водопроводной воды берут 1500 г аммиачной селитры. При этом плотность должна составлять 1,3. После центрифугирования металлической петлей диаметром 5 мм с пробирки снимают поверхностную пленку, переносят ее на хорошо обезжиренное предметное стекло, делают мазок, который высушивают, фиксируют и окрашивают по выше указанному методу. [ 7] Лечение. Для лечения телят при криптоспоридиозе назначают сульфадимезин в дозе 0,1 г/кг 2 раза в день в течение 6 дней; химкокцид-7 по 0,04 г/кг 2 раза в день в течение 4 дней; норсульфазол в дозе 0,05 г/кг 3 раза в день в течение 3 дней. Хороший эффект получен от сочетаний сульфадимезина с фумаровой кислотой; триметазульфа по 4 мл на 50 кг массы 2 раза в день в течение 6 дней. Ягнятам и поросятам назначают сульфадимезин по 0,05 г/кг два раза в день в течение 6 дней; сульфадиметоксин по 0,05 г/кг 1 раз в день в течение 5 дней. [5,6] Профилактика и меры борьбы. Для профилактики заражения молодняка животных криптоспоридиями необходимо обеспечить животных сбалансированным кормлением, предоставить молодняку надлежащие условия содержания. Помещения должны быть хорошо вентилируемыми сухими, регулярно очищать клетки и дезинвазировать их 5%-ным горячим (70-80 °С) раствором натрия гидроокиси. Проводить дератизацию. Если это криптоспоридиоз молодых особей, а также в случае оппортунистической инвазии, быстрое излечение происходит после избавления от первичного заболевания или после устранения упущений владельцев. Напротив, массовое нахождение ооцист Cryptosporidium Spp в кале взрослых животных должно стать сигналом серьёзного заболевания и вытекающего из этого недостаточного иммунитета организма. Из собственного опыта авторы подтверждают, что они встречались с криптоспоридиозом не только у животных в результате хронического поражения пищеварительного тракта а также у животных с гипотиреозом, синдромом Кушинга, у кошек с вирусами лейкемии или иммунодефицита, а также у собак после лечения кортикостероидами. [7]
Предупреждение
Зооноз. В связи с низкой видоспецифичностью в определённых случаях может произойти заражение человека от животных. Прежде всего, это вид C. Parvum. У полностью иммунокомпетентных людей протекает несколько дней в виде асимптоматической инвазией, у детей бывают поносы. Разумеется, что человек может заразиться и от других людей, особенно в детских коллективах. Вероятно, криптоспоридиоз является причиной Поносов во время путешествий.
У Иммунодефицитных пациентов (типичным примером является ВИЧ-инвазированный человек) инвазия криптоспоридиозом является одним из наиболее часто встречающихся осложнений и долговременные профузные поносы нередко приводят к летальному исходу. Кроме СПИДа инвазия небезопасна для особей с конгенитальной гипогамаглобинурией, иммуносупрессией после химиотерапии, например, кортикостероидами, при истощении организма длительными физическими нагрузками, при стрессе или хронических заболеваниях.
Собственные исследования. 2.1. Характеристика хозяйства. ЗАО «Красный маяк» находится в Ростовском районе Ярославской области, в 68 км от г. Ярославля. В состав хозяйства входит 1 деревня: д. Василево. ЗАО «Красный маяк» имеет 6567 га земли, из них 3675 га сельскохозяйственные угодья, в том числе 2043 га пашни, 718 га сенокосов и 803 га пастбищ. Природные условия зоны благоприятны для развития молочного животноводства. ЗАО «Красный маяк» Ярославской области занимается молочным животноводством и производством зерна, разводит крупный рогатый скот ярославской, помесной и голштино – фризской породы. Общее поголовье крупного рогатого скота в хозяйстве 1420 голов. Структура стада: быки-производители – отсутствуют, по причине получения статуса племенного хозяйства; коровы –620 голов; нетели –120 голов; тёлки 2010 г. рождения –180 голов; бычки 2010г. рождения –55 голов; тёлки 2011 г. рождения –230 голов; бычки 2011 г. рождения –215 голов. В зимний период применяется беспривязное содержание взрослого скота и боксово-беспривязное содержание молодняка. А также холодный метод содержания телят. Содержание коров в помещении беспривязное, секции разделены на группы: отел от 0 до 30 дней, от 30 дней до 100, от 100 до 150, от 150 и до сухостойного периода. Раздача кормов производится мобильными кормораздатчиками, доение осуществляется в молокопровод, поение производится из поилок расположенных в секциях, навозоудаление скрейперное. Рацион для молочных коров состоит из силоса кукурузного – 25 кг, дерти овсяной – 1 кг, соли поваренной – 90 г. Поение вволю из автопоилок. Почвы хозяйства представлены серыми лесными и чернозёмами. Значительную площадь занимают солонцы. Для производства молока и воспроизводства стада используется следующая схема: молочные коровы содержатся в молочном цехе, где производится и искусственное осеменение. Стельные коровы и нетели за 2 недели до отёла переводятся в родильное отделение. Новорожденные телята на сутки остаются с матерью, затем до 10 – ти дневного возраста выращиваются в профилактории. Потом их переводят в телятник, где формируют группы по 10-15 голов. С 6 мес. возраста телят разделяют по полу, бычков кастрируют и ставят на откорм, тёлочек бонитируют лучшие идут на воспроизводство стада, остальные ставятся на откорм.
2.2. Цель и задачи исследования. Целью работы является изучение распространения криптоспоридиоза крупного рогатого скота в ЗАО «Красный маяк» и эффективности применяемых препаратов для проведения лечебно-профилактических мероприятий. 2.3. Материалы, методы и результаты исследований. При написании работы были взяты 2 группы телят по 20 голов в каждой, в возрасте 2-х лет.
Как известно, кровь составляет внутреннюю среду организма, так как, соприкасаясь со всеми тканями и клетками, она обеспечивает их жизнедеятельность, являясь посредником между внешней средой и клетками. У высших животных кровь практически омывает все клетки, доставляя к ним необходимые вещества и унося от них продукты жизнедеятельности. Состав крови свидетельствует о нормальных и патологических процессах, происходящих в организме. Кровь соединяет химические процессы различных частей тела в целостную систему. У высших животных наряду с нервной системой, обеспечивающей регуляцию организма, сформировалась кровеносная система. Как внутренняя среда она осуществляет связь всех органов и тканей, создавая необходимый режим их существования. Наиболее полно обмен веществ между кровью и тканями протекает а капиллярной системе. В организме животных кровь выполняет транспортную роль (транспорт кислорода к тканям и углекислого газа от тканей к легким, транспорт питательных веществ и удаление из тканей конечных продуктов обмена); регуляторную (поддерживает постоянно рН и осмотическое давление, доставляет к тканям гормоны); защитную (ее антитела и лейкоциты, связывая возбудителей болезней и продукты их жизнедеятельности, предохраняют организм от заболевания). Целью наших исследований явилось изучение морфологических показателей крови животных, инвазированных ооцистами криптоспоридий экспериментально и спонтанно. Для проведения экспериментальных исследований было использовано10 телят, из которых образовывали в соответствии с общими правилами по принципу аналогов одну опытную из 10 голов и 1 контрольную группу - 10 голов. При спонтанном заражении также было использовано20 голов, которые были разделены, как и при экспериментальном заражении.
Животных содержали в одинаковых условиях. В зависимости от цели и задач исследований экспериментальных телят инвазировали суспензией ооцист криптоспоридий в дозе 1 тыс. на 1 кг живой массы. Содержали телят в одинаковых условиях исключающих естественное заражение, что подтверждается трёхкратным отрицательными результатами копрологических исследований и отсутствием простейших и других паразитов у контрольных животных в течение эксперимента. Кровь для гематологического анализа брали из яремной вены. Кровь брали до заражения и после заражения на 4-е, 8-е, 10-е, 12-е, 14-е сутки. Для осуществления поставленной задачи у всех животных учитывались: общее клиническое состояние, температура тела, частота пульса, изменение живого веса, содержание гемоглобина, эритроцитов, лейкоцитов, СОЭ резервную щелочность определяли по общепринятым методам. Полученные данные анализировали и обрабатывали с помощью стандартных компьютерных программ статистической обработки. Проявление клинической картины криптоспоридиоза у телят (средняя степень инвазии) большей частью начинается периодическим ухудшением общего состояния. Затем появляются симптомы расстройства пищеварения: понос, снижение аппетита, отставание в росте, что составляло снижением массы тела поросят и прирост массы подопытных животных составляло 50 - 55 г. При клиническом осмотре и термометрии установлено, что температура тела у всех подопытных поросят была незначительно повышена на 8-е и 10-е сутки после заражения и составляла от 40,6 до 40,4 0С, когда в организме поросят происходит массовое размножение и выделение ооцист C.parvum во внешнюю среду, а в остальные дни у всех подопытных поросят была в пределах нормы и колебалась от 38,6 до 39,6 0С. Отклонений в приеме молозива у телят не отмечали. Количество эритроцитов в крови телят составляло от 7,0 ± 0,34 млн/мм3 (Р<0,05) до 4,56 ± 1,10 млн/мм3 (Р<0,05) на десятые сутки после заражения. Зараженность телят ооцистами C.parvum отрицательно повлияла на гематологические показатели. Так, у телят, экспериментально инвазированных криптоспоридиями было на 2 раза эритроцитов ниже, чем в контрольной группе. К началу массового выделения ооцист криптоспоридий (на 8-е и 10-е сутки) наблюдается некоторое снижение эритроцитов, а к 14-ти суткам количество их заметно стало приближаться к уровню контрольных животных. У телят, инвазированных спонтанно, на 8-е, 10-е сутки во втором опыте эритроцитов было 5,05 ± 0,07 млн/мм3 (Р<0,05) против 5,71 ± 0,19 млн/мм3 (Р<0,05) у контрольных (5,05 ± 0,07 млн/мм3 (Р<0,05) в начале опыта). Имеющаяся разница в количестве эритроцитов в крови животных контрольной и опытной групп при статистической обработке оказалась достоверной. Самое низкое количество лейкоцитов было у телят на первый день после заражения и равнялось 8,65 ± 0,01 тыс./мм3 (Р<0,05), а на восьмые сутки уже составляло 13,80 ± 0,93 тыс./мм3 (Р<0,05) и в последующем держалось на весь момент исследования, т.е. до 14-ти суток. Скорость оседания эритроцитов (СОЭ) колебалось с 1,9 до 2,7 мм/ч (Р<0,05), 4-е сутки после заражения составляло 2,0 ± 0,06 мм/ч (Р<0,05), а на 6-е и 8-е сутки после заражения составляло с 2,3 ± 0,06 мм/ч (Р<0,05) до 2,7 ± 0,07 мм/ч (Р<0,05).
Анализ результатов исследований и литературных данных позволяет сделать заключение, что криптоспоридии способствуют изменению гематологических показателей и происходит максимальное повышение уровня лейкоцитов, уменьшению количества эритроцитов. Эти данные согласуются с показателями других животных, которые приводит в своих исследованиях Кряжев А.Л. (2004; 2005). Так как кровь обеспечивает взаимосвязь обменных процессов, протекающих в различных органах и тканях, выполняет защитную, транспортную, регуляторную, дыхательную, терморегулирующую и другие функции. Морфофункциональный анализ крови позволяет весьма объективно оценить действие различных факторов на организм, хотя эти реакции и не всегда специфичны. Поэтому биохимическая характеристика крови очень важна для оценки патологических и предпатологических состояний организма (рис. 3).
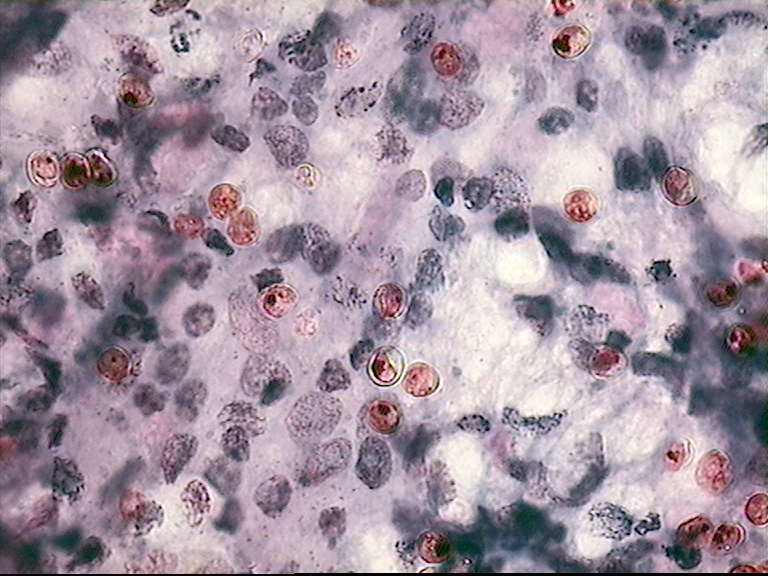
Рис. 3. Наличие криптоспоридий в мазках. Также в хозяйстве проводились экспресс тесты на наличие в фекалиях телят криптоспоридий: при этом брали возрастную группу телят на 21 день после рождения – (критическая группа) количеством 10 голов. Для проведения теста были взяты 10 одноразовых полимерных колб с реактивом светло - розового цвета, в колбы были помещены по1 г фекалий от каждого теленка и помещены в каждую колбу. Колбы закрыли и вращательными движениями смешивали фекалии с реактивом, вращение производилось спокойными колебательными движениями, и были оставлены в вертикальном положении в штатив и оставлены на 30 минут. По прохождении времени реактив поменял свой цвет от светло- розового до темно соломенного цвета – что соответствует наличию в организме телят возбудителей криптоспоридиоза. Телята из контрольной группы были переведены в отдельный бокс для проведения дополнительных лабораторных исследований, а также фекалии были отобраны и у тех телят, которые находились в одной половозрастной группе вместе с изолированными телятами.
|
|||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 33; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.142.146 (0.029 с.) |