Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особенности пространственного строения предельных углеводородов. ⇐ ПредыдущаяСтр 2 из 2
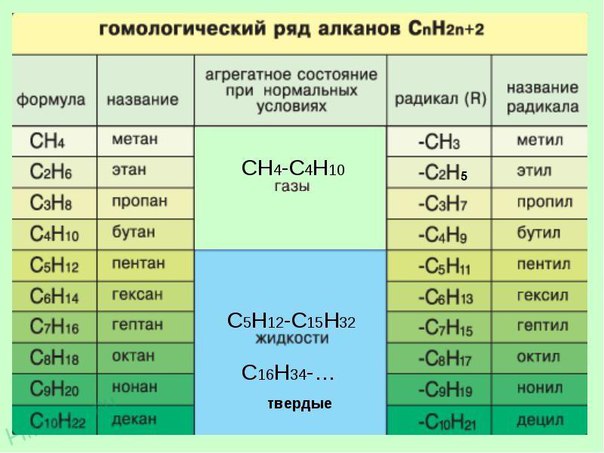
СН4 – молекулярная формула (качественный, количественный состав); Молекула метана в действительности имеет форму тетраэдра. Тетраэдр – это пирамида, в основании которой лежит равносторонний треугольник. В центре тетраэдра находится атом углерода, а все его четыре валентности направлены к вершинам тетраэдра. Физическими методами исследования установлено, что валентные углы равны 109о28'. 1. Почему молекула метана имеет такую пространственную форму? 2. Чем объясняется направление валентных связей атома углерода от центра к вершинам тетраэдра? Ответ следует искать в электронном строении атома углерода и молекулы метана. С 1S2 2S2 2P2 (основное состояние) (возбужденное состояние) Так как на втором энергетическом уровне Р-подуровне есть свободная орбиталь, то на неё переходит один из 2 S 2 -электронов. В результате этого атом углерода в возбуждённом состоянии имеет четыре неспаренных электрона, т.е. становится четырёхвалентным. Облака всех четырёх валентных электронов атома углерода выравниваются, становятся одинаковыми. При этом они принимают форму вытянутых в направлении к вершинам тетраэдра восьмёрок. Явление, при котором происходит смешение и выравнивание по форме и энергии электронных облаков, называется гибридизацией. Так как гибридизации подвергаются один S и три Р -электрона, то такое состояние называется SP3 -гибридизацией. Несимметричное распределение электронной плотности означает, что вероятность нахождения электрона по одну сторону от ядра больше, чем по другую. Гибридные электронные облака вытянуты в пространстве под углом 109о28' к вершинам воображаемого тетраэдра, и в этом направлении они перекрываются с электронными облаками атомов водорода. Итак, молекула метана имеет тетраэдрическое строение, что обусловлено SP3-гибридизацией атома углерода, тетраэдрическим направлением четырёх гибридных электронных облаков атома углерода. Гомологический ряд метана. Существует много углеводов, сходных с метаном, то есть гомологов метана. В их молекулах имеются 2, 3, 4 и более атомов углерода. Каждый последующий углеводород отличается от предыдущего группой атомов СН2. Например, если к формуле СН4 прибавить группу СН2, получим следующий углеводород С2Н6 – этан – гомолог метана. Группа СН2 называется гомологической разностью.
Для предельных углеводородов характерна общая формула: С n H 2 n +2, где n – целое число атомов углерода. Пример: n=5 C5Н2Х5+2=С5Н12 – пентан n=8 C8Н2Х8+2=С8Н18 – октан Для названия углеводородов используют две номенклатуры: историческую (случайные названия) и систематическую. Для составления названия алканов по систематической номенклатуре нужно: 1.Выбрать самую длинную неразветвленную цепь углерода. 2.Пронумеровать эту цепь таким образом, чтобы заместители, которые в молекулах углеводородов замещают атомы водорода, были ближе к началу цепи. 3.Указать цифрой место и название заместителя, затем название основной цепи с суффиксом –ан. Для этого нужно знать название радикалов (образуются при отщеплении атома водорода от атома углерода), которые образуются от названий соответствующих углеводородов, путём замены суффикса –ан на –ил. СН4 - метан, СН3 - метил С2Н6 – этан, С2Н5 – этил С3Н8 – пропан, С3Н7 – пропил Для примера рассмотрим молекулу гексана и составьте несколько изомеров, дав им названия по международной номенклатуре. Получение: Лабораторные способы: 1.при нагревании ацетата натрия с твердым гидроксидом натрия CH3COONa + NaOH → CH4 + Na2CO3 ацетат натрия 2. реакцией Вюрца: CH3Cl + 2Na → CH3 - CH3 + 2NaCl хлорметан этан Физические свойства. С увеличением Mr закономерно изменяются: а) агрегатное состояние углеводородов С1-С4 – газы, С5-С16 – жидкости, n > 16 – твердые вещества, б) увеличиваются tпл и tкип., в) уменьшается растворимость. Химические свойства. Предельные углеводороды характеризуются малой реактивной способностью. Сегодня на уроке познакомимся с взаимодействием алканов с кислородом, галогенами, термическим разложением, изомеризацией. 1. Горючесть алканов. При поджигании (t = 600oС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды. СnН2n+2 + O2 → CO2 + H2O + Q например: СН4 + 2O2 → CO2 + 2H2O + Q Смесь метана с кислородом или воздухом при поджигании может взрываться. Наиболее сильный взрыв получается при объёмных отношениях 1: 2 (с кислородом) или 1: 10 (с воздухом), т.к. метан и кислород вступают в реакцию полностью.
Подобные смеси опасны в каменноугольных шахтах. Чтобы обеспечить безопасность работы в шахтах, там устанавливают анализаторы, сигнализирующие о появлении газа, и мощные вентиляционные устройства. С3Н8 + 5O2 → 3CO2 + 4H2O + Q Гор18ние пропан-бутановой смеси можно продемонстрировать на примере газовой зажигалки. При горении алканов выделяется много теплоты, что позволяет использовать их в качестве источника энергии. Но большая часть их используется в качестве сырья для получения других продуктов. 2. Разложение алканов. СnН2n+2 Метан в термическом отношении более устойчив, чем другие алканы. Причина этого в достаточной прочности С – Н связей. 3. Реакции замещения (протекают с галогенами и другими окислителями при определённых условиях: свет, температура). СН4 + Cl2 СН2Cl2 + Cl2 Механизм цепных реакций достаточно сложен, объяснение ему было дано русским учёным Н.Н. Семёновым, за что он в 1956 г. был удостоен Нобелевской премии. Применение. Студентам было дано домашнее задание к этому уроку принести слайды на тему «Применение предельных углеводородов».(Приложение) 2. Самостоятельная работа: Задание 1: Выполните тест 1. Укажите ошибочное определение алканов: а) предельные углеводороды; б) карбоциклические соединения (в молекулах имеются циклы); в) насыщенные углеводороды; г) парафиновые углеводороды. 2. Общая формула алканов: а) СnH2n; б) СnH2n+1; в) СnH2n+2; г) СnН2n-2. 3. Признаки, характеризующие строение алканов: а) SP3 -гибридизация, плоская форма молекул в) SP3 -гибридизация, форма молекул – тетраэдр 4. Невозбуждённый атом углерода имеет электронную конфигурацию: а) 1 S 22 S 12 P 3; б) 1 S 22 S 22 P 2; в) 1S22S22P3; г) 1S22S22P4. 5. Возбужденный атом углерода имеет электронную конфигурацию: а) 1S22S22P3; б) 1S22S22P2; в) 1S22S22P4; г) 1S22S12P3. 6. Всем алканам присущи свойства: а) вступать в реакцию замещения; б) окисляться при обычных условиях; Задание 2: Приготовить сообщения на темы: 1. Применение предельных углеводородов. 2. Классификация реакций в органической химии.
Химия 4 Тема урока: Составление структурных формул и названий алканов по международной и тривиальной номенклатурам. Тип урока: Практическая работа План урока:
Ход урока: 3. Предельные углеводороды – это углеводороды с общей формулой С n Н2 n -2 , которые не присоединяют водород и другие элементы. 4. СН4 – молекулярная формула (качественный, количественный состав); Молекула метана в действительности имеет форму тетраэдра. Тетраэдр – это пирамида, в основании которой лежит равносторонний треугольник. В центре тетраэдра находится атом углерода, а все его четыре валентности направлены к вершинам тетраэдра.
5. Явление, при котором происходит смешение и выравнивание по форме и энергии электронных облаков, называется гибридизацией. Так как гибридизации подвергаются один S и три Р -электрона, то такое состояние называется SP3 -гибридизацией. 6. Для составления названия алканов по международной номенклатуре нужно: 1.Выбрать самую длинную неразветвленную цепь углерода. 2.Пронумеровать эту цепь таким образом, чтобы заместители, которые в молекулах углеводородов замещают атомы водорода, были ближе к началу цепи. 3.Указать цифрой место и название заместителя, затем название основной цепи с суффиксом –ан. Для этого нужно знать название радикалов (образуются при отщеплении атома водорода от атома углерода), которые образуются от названий соответствующих углеводородов, путём замены суффикса –ан на –ил. 4. Использовать гомологический ряд алканов. Задания для практической работы(номер варианта соответствует списочному номеру журнала)
Химия 5 Тема урока: Непредельные углеводороды, строение, свойства и применение в органическом синтезе. Понятие о диенах. Натуральный и синтетические каучуки. Резина. Тип урока: Изучение нового материала. План урока: 16. Изучите материал в соответствии с темой (гл. 2, параграф 7 стр. 38, параграф 8 стр. 43, параграф 9, стр. 48) 17. Выполните самостоятельную работу. 18. Для изучения и выполнения заданий используйте учебное пособие по химии:. Органическая химия. 11 класс. Базовый уровень: учебник для общеобразовательных учреждений / И.И. Новошинский, Н.С. Новошинская. – 5 –е изд. – М.: ООО «ТИД «Русское слово - РС», 2011. – 176с. 1. Выполненное задание направить мне на ЭЛЕКТРОННЫЙ АДРЕС: lud.bas@mail.ru
Ход урока: Самостоятельная работа: 1. Составить возможные изомеры: задание 2 стр. 60. 2. Составить уравнения химических реакций в соответствии с цепочкой превращений: задание 6 стр. 53. .
Химия 6 Тема урока: Ароматические углеводороды, их свойства и применение. Природный газ: состав, применение в качестве топлива. Тип урока: Изучение нового материала. План урока: 19. Изучите материал в соответствии с темой (гл. 2, параграф 12 стр. 63-68, параграф 14 стр. 70-75) 20. Выполните самостоятельную работу. 21. Для изучения и выполнения заданий используйте учебное пособие по химии:. Органическая химия. 11 класс. Базовый уровень: учебник для общеобразовательных учреждений / И.И. Новошинский, Н.С. Новошинская. – 5 –е изд. – М.: ООО «ТИД «Русское слово - РС», 2011. – 176с. 22. Выполненное задание направить мне на ЭЛЕКТРОННЫЙ АДРЕС: lud.bas@mail.ru
Ход урока: Самостоятельная работа: 1. Ответьте на вопросы: задание 1 стр. 69. 2. Составьте кроссворд из 10 вопросов по теме: Природные источники углеводородов.
Химия 7 Тема урока: Построение моделей непредельных и ароматических углеводородов, написание их структурных формул и химических реакций на основе свойств. Тип урока: Практическая работа План урока:
Ход урока: Задание 1. Напишите пять структурных формул изомеров состава и назовите их по международной номенклатуре:
Задание 2. Напишите структурные формулы непредельных углеводородов:
Задание 3. Напишите структурные формулы ароматических углеводородов.
Химия 8 Тема урока: Одноатомные и многоатомные спирты, их строение, химические свойства, применение. Фенолы. Составление структурных формул и химических реакций спиртов и фенолов на основе изученных свойств Тип урока: Практическая работа План урока:
Органическая химия. 11 класс. Базовый уровень: учебник для общеобразовательных учреждений / И.И. Новошинский, Н.С. Новошинская. – 5 –е изд. – М.: ООО «ТИД «Русское слово - РС», 2011. – 176с. 2. Выполненное задание направить мне на ЭЛЕКТРОННЫЙ АДРЕС: lud.bas@mail.ru
Ход урока: 1. Предельные одноатомные спирты (алканолы) содержат одну гидроксильную группу –ОН, соединённую с насыщенным углеводородным радикалом. Общая формула алканолов: СnH2n+1OH Гидроксильная группа – ОН является функциональной группой спиртов. Функциональными группами называются группы атомов, которые обусловливают характерные химические свойства данного класса веществ. Гомологический ряд алканолов: CH3OH метанол, метиловый спирт C2H5OH этанол, этиловый спирт C3H7OH пропанол C4H9OH бутанол C5H11OH пентанол и т.д. Изомерия C4H9OH CH3 – CH2 – CH2 – CH2 – OH бутанол-1 СН3-СН-СН2-ОН СН3-СН2-СН-СН3 СН3 ОН 2-метилпропанол-1 2-бутанол Физические свойства. Одноатомные предельные первичные спирты с короткой цепью углеродных атомов – жидкости, а высшие (начиная с С12Н25ОН) – твёрдые вещества. Метанол, этанол, пропанол – бесцветные жидкости, растворимы в воде, имеют спиртовой запах. Метанол – сильный яд. Все спирты ядовиты, обладают наркотическим действием. Химические свойства 1. Растворы спиртов имеют нейтральную реакцию на индикаторы 2. Взаимодействие с щелочными металлами 2C2H5OH + 2Na → 2C2H5ONa + H2 этанол этилат натрия 3. Взаимодействие с галогеноводородами C2H5OH + HCl →C2H5Cl + H2O хлорэтан 4. Дегидратация (при t и в присутствии H2SO4) C2H5OH → C2H4 + H2O этилен 2 C2H5OH→ C2H5 –О— C2H5 диэтиловый эфир 5. Горение C2H5OH + 3O2 → 2CO2 + 3H2O +Q 6. Окисление C2H5OH + CuO → Cu + H2O + CH3-CHO этанол уксусный альдегид 7. Взаимодействие с карбоновыми кислотами (реакция этерификации) C2H5OH + CH3COOH → CH3COOC2H5 + H2O Получение этанола: Этанол получают из 1) этилена: C2H4 + HOH → C2H5OH (при катализаторе и t) 2) брожением глюкозы: C6H12O6 → 2C2H5OH + 2CO2 Применение этанола: получение уксусной кислоты, лекарств, духов и одеколонов, каучуков, горючего для двигателей, красителей, лаков, растворителей и других веществ. 12. Глицерин – представитель многоатомных спиртов. Строение, физические и химические свойства (реакция этерификации), применение. Глицерин – трёхатомный спирт: СН2ОН СНОН СН2ОН Глицерин – бесцветная сиропообразная жидкость сладковатого вкуса, хорошо растворимая в воде, гигроскопичная. Глицерин получают расщеплением жиров. Химические свойства. 1. Взаимодействие с щелочными металлами СН2ОН CH2ONa СНОН + 2Na → CHONa + H2 СН2ОН CH2OH 2. Взаимодействие с галогеноводородами СН2ОН CH2Cl СНОН +3HCl → CH Cl + 3H2O СН2ОН CH2Cl Применение глицерина – в медицине – для смягчения кожи и приготовлении мазей, в кожевенном производстве – для предохранения кож от высыхания, для получения пластмасс и взрывчатых веществ (нитроглицерин). Фенол С6Н5ОН – бесцветное, кристаллическое вещество с характерным запахом. Его t плавления = 40,9 С. В холодной воде он мало растворим, но уже при 70◦С растворяется в любых отношениях. Фенол ядовит. В феноле гидроксильная группа соединена с бензольным кольцом Практическая работа: Задание 1. Напишите структурные формулы пяти изомеров и назовите по международной номенклатуре согласно вашему варианту в таблице:
Задание 2. Напишите структурные формулы следующих веществ:
Задание 3. Напишите возможные химические реакции для этилового спирта, характеризующие его химические свойства.
Химия 9 Тема урока: Понятие об альдегидах и карбоновых кислотах, их структурах, свойствах и применении в технике и промышленности. Составление структурных формул и химических реакций на основе изученных свойств. Тип урока: Практическая работа План урока: 26. Повторите основные понятия темы. 27. Выполните практическую работу (номер варианта соответствует списочному номеру журнала) 28. Для изучения и выполнения заданий используйте учебное пособие по химии: Органическая химия. 11 класс. Базовый уровень: учебник для общеобразовательных учреждений / И.И. Новошинский, Н.С. Новошинская. – 5 –е изд. – М.: ООО «ТИД «Русское слово - РС», 2011. – 176с. 3. Выполненное задание направить мне на ЭЛЕКТРОННЫЙ АДРЕС: lud.bas@mail.ru
Ход урока: Практическая работа: Задание 1. Напишите структурные формулы следующих органических соединений:
Задание 2. Напишите структурные формулы (5 изомеров) и назовите изомерные вещества согласно вашему варианту по международной номенклатуре:
Задание 3. Какая предельная одноосновная кислота получится при окислении
Напишите уравнения реакций взаимодействия Н2 и назовите продукты реакции:
Химия 10 Тема урока: Сложные эфиры, жиры, хим. свойства жиров. Мыла, углеводы, общие понятия, строение и свойства. Тип урока: Изучение нового материала. План урока:
Органическая химия. 11 класс. Базовый уровень: учебник для общеобразовательных учреждений / И.И. Новошинский, Н.С. Новошинская. – 5 –е изд. – М.: ООО «ТИД «Русское слово - РС», 2011. – 176с. 4. Выполненное задание направить мне на ЭЛЕКТРОННЫЙ АДРЕС: lud.bas@mail.ru
Ход урока: Самостоятельная работа: 1. Какие соединения называют сложными эфирами, жирами, углеводами? 2. Какими свойствами обладают сложные эфиры и жиры? Есть ли принципиальная разница между понятиями «жир» и «масло»? 3. Как можно приготовить маргарин? Чем он отличается от сливочного масла? 4. Какой продукт называют мылом? Почему обычное мыло не «моет» в морской воде? 5. Напишите структурную формулу сложного эфира, образованного глицерином с пальмитиновой, стеариновой и масляной кислотами. 6. Составьте уравнение реакции получения метилформиата, триолеина, трибутирата. 7. В чем сходство и различие в строении крахмала и целлюлозы? 8. Назовите качественные реакции на крахмал, целлюлозу и глюкозу.
Химия 11 Тема урока: Составление структурных формул, химических реакций кислородсодержащих соединений на основе изученных свойств. Тип урока: Практическая работа План урока:
Органическая химия. 11 класс. Базовый уровень: учебник для общеобразовательных учреждений / И.И. Новошинский, Н.С. Новошинская. – 5 –е изд. – М.: ООО «ТИД «Русское слово - РС», 2011. – 176с. 5. Выполненное задание направить мне на ЭЛЕКТРОННЫЙ АДРЕС: lud.bas@mail.ru
Ход урока: Задание 1. Напишите структурные формулы следующих веществ:
Задание 2. Напишите структурную формулу сложного эфира:
Задание 3: 1. Для чего применяется сахароза: а) как питательное вещество; б) сырье для получения уксусной кислоты; в) для получения крахмала; г) для получения глюкозы. 2. Какие продукты образуются в результате окисления глюкозы аммиачным раствором Ag2O: а) глюконовая кислота и вода; б) глюкосахарат серебра и вода; в) спиртокислота и серебро; г) многоатомный спирт и вода. 3. Какие группы веществ дают реакцию серебряного зеркала: а) глюкоза, глицерин, этиленгликоль; б) глицерин, глюкоза, сахароза; в) глюкоза, формальдегид, метановая кислота; г) глюкоза, молочная кислота, фруктоза. 4. Какие из перечисленных углеводородов относятся к дисахаридам: а) фруктоза; б) мальтоза; в) крахмал; г) сахароза. 5. С какими из перечисленных реактивов крахмал дает качественную реакцию: а) с Cu(OH)2; б) с раствором Y2; в) с Ag2O (аммиачный раствор); г) с уксусной кислотой. 6. Вещество, формула которого C6H12O6 называется….. и является……: а) углеводом, глюкозой; б) фруктозой, углеводом; в)сахарозой,углеводом; г) моносахаридом, углеводом. 7. Целлюлоза относится к…….: а) углеводам, дисахаридам; в) углеводам, полисахаридам; б) углеводам, моносахаридам; г) сложным эфирам. Химия 12 Тема урока: Аминокислоты и белки, их свойства, применение на основе свойств. Белки и полисахариды как биополимеры. Изучение хим. свойств белков Тип урока: Комбинированный. План урока:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 117; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.152.251 (0.196 с.) |
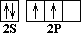 ––> C * 1S2 2S1 2P3
––> C * 1S2 2S1 2P3 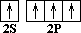
 C + H2↑; СН4
C + H2↑; СН4  CH3Cl + HCl СН3Cl + Cl2
CH3Cl + HCl СН3Cl + Cl2 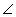 120о,
120о,  и
и 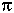 -связи;
-связи;