
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Объясняется это тем, что карбонаты в водных растворах образуют сильнощелочную среду, а фенол- КАРБОЛОВАЯ кислота.
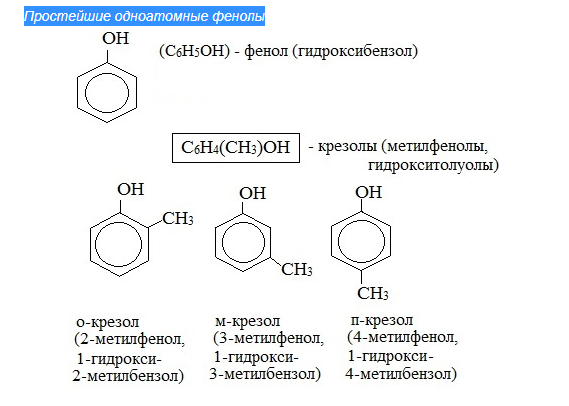
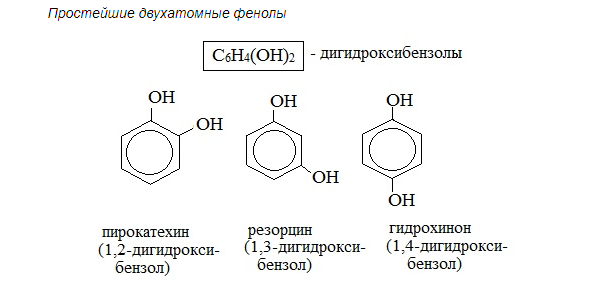
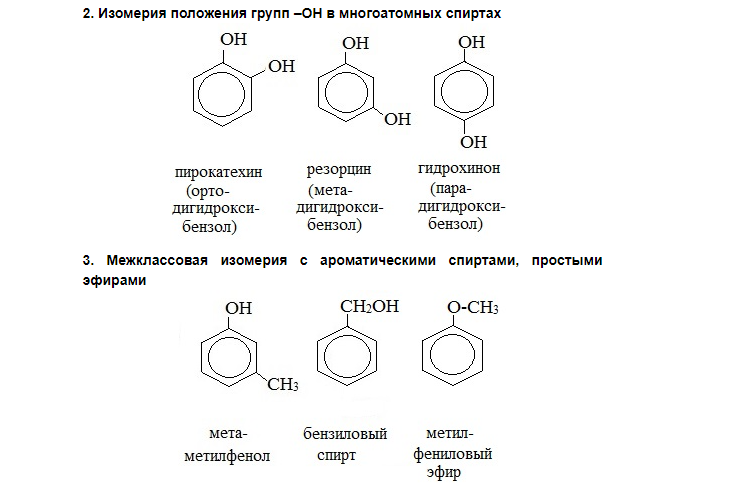
НОМЕНКЛАТУРА Фенолов. Для фенолов широко используют тривиальные названия, сложившиеся исторически: фенол, гидрохинон, резорцин и др. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара-, употребляемые в номенклатуре ароматических соединений.
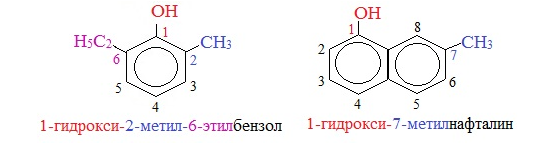
Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей. При построении номенклатуры фенолов атомы углерода в бензольном кольце обозначают цифрами от 1 до 6, начиная с атома углерода, связанного с гидроксильной группой.
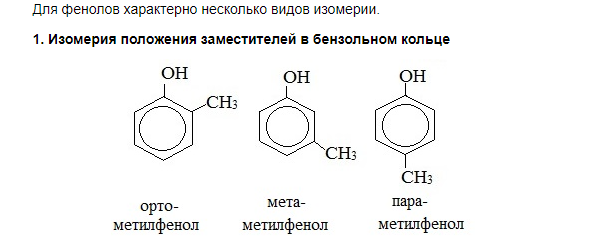
Виды изомерии у фенолов.
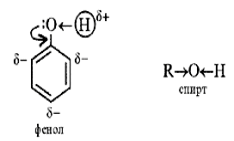
Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей
Это объясняет, почему у фенола довольно высокие температуры плавления (+43) и кипения (+ 182). Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:

Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксисоединений к одноатомным. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена. · неподеленная электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из – за чего связь О – Н еще сильнее поляризуется. Фенол- более сильная кислота, чем вода и спирты. Фенол называют КАРБОЛОВОЙ КИСЛОТОЙ. · В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2, 4, 6, поскольку OH-группа является очень сильным донорным заместителем (проявляет +M-эффект, значительно превышающий -I). Это делает более реакционноспособными связи С - Н в положениях 2, 4, 6 (орто- и пара-) и активирует кольцо в реакциях электрофильного замещения.
Химические свойства фенола. I.Кислотные свойства. Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно,
!Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
Поэтому в отличии от карбоновых кислот фенол не может вытеснять угольную из ее солей!
С гидрокарбонатами не реагирует, а с карбонатами натрия и калия вступает в реакцию! III. Образование простых и сложных эфиров. Простые эфиры нельзя непосредственно получить из фенола! Их получают из фенолятов при взаимодействии последних с галогеналканами или галогенпроизводными бензола (синтез Вильямсона):
V. Реакции окисления
VI. Восстановление (гидрирование фенола) Эта реакция идет в жёстких условиях с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
Способы получения фенола 1. Получение из каменноугольной смолы (промышленный способ): каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем – кислотой:
Затем фенолят натрия обрабатывают самой слабой угольной кислотой:
НОМЕНКЛАТУРА Фенолов. Для фенолов широко используют тривиальные названия, сложившиеся исторически: фенол, гидрохинон, резорцин и др. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара-, употребляемые в номенклатуре ароматических соединений.
Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей. При построении номенклатуры фенолов атомы углерода в бензольном кольце обозначают цифрами от 1 до 6, начиная с атома углерода, связанного с гидроксильной группой.
Виды изомерии у фенолов.
Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей
Это объясняет, почему у фенола довольно высокие температуры плавления (+43) и кипения (+ 182). Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:

Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксисоединений к одноатомным. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена. · неподеленная электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из – за чего связь О – Н еще сильнее поляризуется. Фенол- более сильная кислота, чем вода и спирты. Фенол называют КАРБОЛОВОЙ КИСЛОТОЙ. · В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2, 4, 6, поскольку OH-группа является очень сильным донорным заместителем (проявляет +M-эффект, значительно превышающий -I). Это делает более реакционноспособными связи С - Н в положениях 2, 4, 6 (орто- и пара-) и активирует кольцо в реакциях электрофильного замещения.
Химические свойства фенола. I.Кислотные свойства. Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
Поэтому в отличии от карбоновых кислот фенол не может вытеснять угольную из ее солей!
С гидрокарбонатами не реагирует, а с карбонатами натрия и калия вступает в реакцию! Объясняется это тем, что карбонаты в водных растворах образуют сильнощелочную среду, а фенол- КАРБОЛОВАЯ кислота. C 6 H 5 OH + K 2 CO 3 = C 6 H 5 OK + H 2 O + CO 2 При введении в кольцо сильных акцепторных заместителей (к примеру, -NO2 или -C≡N) кислотность фенола значительно возрастает, поскольку акцепторные группы стабилизируют образующийся при депротонировании OH-группы фенолят-анион за счёт делокализации отрицательного заряда. К примеру, 2,4,6-тринитрофенол (пикриновая кислота) легко вытесняет угольную кислоту из гидрокарбонатов:
|
||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 171; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.70.255 (0.013 с.) |







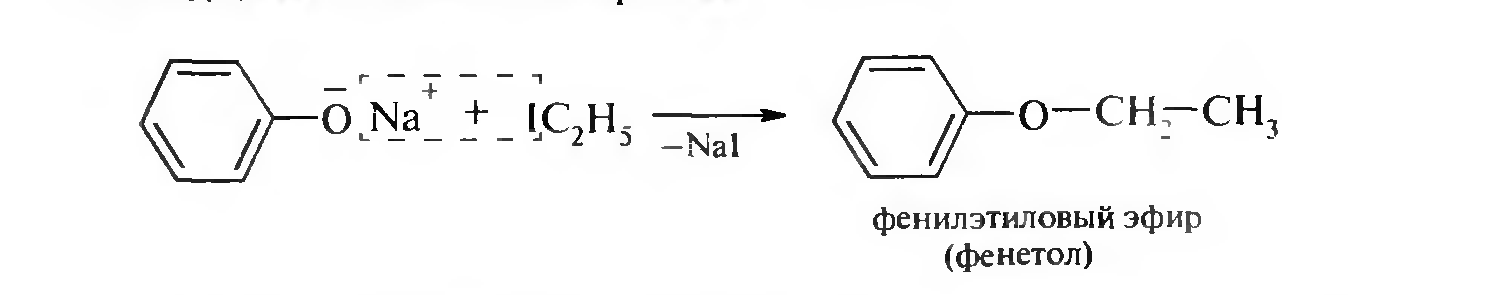


 Бензохинон – кристаллическое вещество желтого цвета
Бензохинон – кристаллическое вещество желтого цвета






