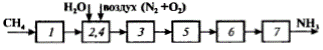Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химико-технологические факторы
1. С целью ускорения процесса любого химического производства требуется максимальное увеличение поверхности реагирующих веществ. Поэтому технологический процесс обычно начинается со специальной предварительной подготовки сырья: механического измельчения (дробления), обогащения и очистки. Приведем следующий пример: кусок антрацита (каменного угля) массой 1 кг может гореть в печи в течении 3-х часов; при измельчении его до прошкообразного состояния время сгорания составляет несколько секунд. Примерами типичных измельчающих устройств, используемых в быту, являются кофемолка, миксер или мясорубка. Выбор наилучшей доступной технологии (НДТ), то есть наиболее технически совершенных методов подготовки сырья и его предварительной очистки, относятся к общим научным основам организации современных химических производств. 2. Многие химические реакции являются экзотермическими, то есть протекают с выделение тепла. С другой стороны, для инициирования многих реакций требуется нагрев до определённых температур. Для этого в производстве используют различные теплообменники, которые позволяют утилизировать тепло химических реакций. Роль теплоносителя чаще всего выполняет вода. Примером использования теплообмена является самовар, в котором теплота горения используется для нагрева воды. Использование тепла химических реакций в технологическом цикле называется теплообменом и относится к технологическим принципам организации химического производства. 3. С целью обеспечения наиболее тесного контакта реагирующих веществ в химических производствах, помимо измельчения этих веществ, требуется также их перемещение относительно друг друга. Для этого используют принцип массообмена и его разновидности - противоток, поток реагирующих веществ в одном направлении и перемешивание, чем достигается наибольшая равномерность течения процесса и полнота использования реагирующих веществ. Перемешивание является типичным примером массообмена, ускоряющим процесс естественной диффузии. 4. Большинство химических производственных процессов - обратимы. С целью ускорения химической реакции и увеличения выхода продукта, в производственных условиях подбирают оптимальные концентрации реагирующих веществ, температуру и давление (для газообразных веществ). Очень часто для изменения направления реакции используют катализаторы (напомним, что использование катализатора не влияет на смещение химического равновесия, так как увеличивает скорости как прямого, так и обратного процессов).
5. Важным технологическим фактором химических процессов является непрерывность производственного процесса, обеспечивающая более высокую производительность труда. Поэтому применение ручных операций, для проведения которых требуется остановка процесса, является нежелательным явлением. С целью обеспечения непрерывности процесса используют автоматические системы управления (АСУ) и механизацию технологического процесса. Экологические факторы 1. С целью наиболее полного использования исходного сырья и ресурсов в химическом производстве применяется также принцип циркуляции вещества. За время прохождения через реакционную установку, то есть за один технологический цикл, исходные вещества не всегда успевают полностью израсходоваться, поэтому непрореагировавшие вещества снова возвращают в аппарат. Например, при синтетическом получении аммиака в контактном аппарате реагирует только 30–37 % смеси азота и водорода; поэтому оставшиеся газы отделяют от образовавшегося жидкого аммиака и с помощью специальных насосов опять направляются в контактный аппарат. Кроме того, наиболее важный и дорогой ресурс - вода, также должен использоваться в производственном процессе многократно. С одной стороны, вода используется в технологических процессах для охлаждения продуктов реакции и нагревания исходных веществ, то есть выполняет функции теплоносителя, обеспечивая выполнение принципа теплообмена. Такие операции повторяются многократно. С другой стороны, вода используется непосредственно в химических реакциях, как растворитель или реагент. Если концентрация загрязняющих веществ в сточных водах не очень высокая, то после очистки реакционная вода также может быть возвращена в технологический цикл. Циркуляционный принцип использования химических веществ и воды – также один из основных принципов организации современного химического производства.
2. Для обеспечения экологической безопасности на химическом производстве используется целый комплекс мероприятий, обеспечивающих защиту окружающей среды. К таким мероприятиям, в первую очередь, относится использование современного очистного оборудования, организация замкнутых сырьевых и ресурсных циклов производства, использование безопасного сырья и др. Все перечисленные факторы и общие принципы организации современных химических производств основываются на закономерностях химических процессов и обеспечивают экологическую безопасность производства, энерго- и ресурсосбережение. Таким образом, к химико-технологическим и экологическим факторам, обеспечивающим выполнение научной организации современных химических производств относятся: · увеличение поверхности реагирующих веществ, · теплообмен (утилизация тепла), · массообмен (противоток), · циркуляция реагирующих веществ, · изменение скорости и направления химических реакций (использование катализатора, оптимальных температур, давления и концентрации), · исключение ручных операций и автоматизация производства; · очистка выбросов и сбросов и утилизация отходов производства
Химическое производство многофункционально – это производство продуктов, экономное использование сырья, материалов и энергии, экологическая безвредность, социальное совершенство. Основные операции или стадии любого химического производства – подготовка сырья, химическое превращение, выделение продуктов, обезвреживание и утилизация отходов тепло и энергообеспечения, водоподготовка, система управления. Первой группой операций является подготовка сырья: измельчение, растворение, нагревание, обогащение, концентрирование, очистка и т.п. Вторая группа операций. После подготовки сырья проводится собственно химическое превращение, в результате чего образуется смесь, химический состав которой отличается от состава исходного сырья. Наличие химического превращения сырья является признаком химического производства. Химическое превращение или химико-технологический процесс разделяется на ряд следующих взаимосвязанных элементарных стадий: а) Физический транспорт веществ; б) Химические реакции могут быть простые и сложные,
последовательные и параллельные, сопровождаемые тепло- и массообменными явлениями; в) Отвод может совершаться также как и подвод реагирующих компонентов диффузией, конвекцией и переходом вещества из одной фазы в другую. Третья группа превращений – выделение и очистка полезного продукта от примесей. Для этого используют разнообразные массообменные процессы, такие как абсорбция, ректификация, экстракция, фильтрование, центрефицирование. Продукты реакции направляют на склад готовой продукции или на дальнейшую переработку. Не прореагировавшее сырьё вновь используют в процессе, организуя его рецикл. На заключительных этапах проводят также рекуперацию энергии и очистку промышленных выбросов, чтобы извлечь из отходящих газов, сточных вод и твёрдых отходов все ценные компоненты, а такжеликвидировать опасные загрязнения окружающей среды. В системе аппаратов химического производства перерабатываются потоки вещества и энергии, которые называются компонентами химического производства. К ним относятся: сырьё, энергия, продукты, полупродукты, отходы. Химико-технологическая система (ХТС) – искусственная техническая система, предназначенная для выпуска химических продуктов высокого качества с минимальными затратами ресурсов и минимальным воздействием на окружающую среду. На практике ХТС соответствуют производственные объединения, химические заводы, химические комбинаты. Рассмотрим в качестве примера ХТС производство аммиака и метанола. Химико-технологическая система (ХТС)производства аммиака. Химическая схема представлена основными реакциями (химическими уравнениями), которые обеспечивают переработку сырья в продукт. Синтез аммиака из водорода и азота представлен одним химическим уравнением: 3Н2 + N2 = 2NН3. Производство аммиака из природного газа (метана) требует проведения нескольких химических реакций: СН4 + Н2О = СО+ 3Н2 – конверсия метана с водяным паром; СО + Н2О = СО2 + Н2 – конверсия оксида углерода; 3Н2 + N2 = 2NН3 – синтез аммиака. Эти уравнения – химическая схема – показывают генеральный путь превращения сырья в продукт. Но реализация превращения не ограничивается только данными уравнениями – необходимы еще стадии, обеспечивающие химические преобразования или детализирующие их. 1. Очистка природного газа от серосодержащих соединений адсорбцией сероводорода, который мешает дальнейшим превращениям:
H 2 S + ZnO = ZnS + Н2О. 2. Конверсия метана с водяным паром. И природный газ СН4, и вода Н2О являются сырьем для получения одного из компонентов для синтеза аммиака – водорода Н2. В этом превращении протекают одновременно две реакции: СН4 + Н2О = СО + 3Н2; СО + Н2О = СО2 + Н2. 3. Конверсия оксида углерода с водяным паром (в предыдущем процессе оксид углерода СО не полностью превращается в СО2 из-за равновесных ограничений): СО + Н2О = СО2 + Н2. После этого процесса достигается максимально возможное извлечение водорода из исходного сырья – метана СН4 и воды Н2О. 4. Получение азота N 2 – второго исходного компонента для синтеза аммиака. В современных схемах его получают «выжиганием» из воздуха кислорода: 3О2 + 2СН4 = 2СО + 4Н2О. Это наиболее простой способ освободить азот воздуха от кислорода, тем более что сжигание части природного газа все равно необходимо для обеспечения теплом всего процесса. Продукты горения – СО и Н2О – участники получения водорода. 5. Абсорбция диоксида углерода – удаление СО2 при получении водорода. Его поглощают раствором моноэтаноламина: СО2 + 2RNH2 + Н2О = (RNН3)2 СО3. 6. Очистка газа от оксида углерода СО. После конверсии небольшое количество СО остается, и он мешает дальнейшим превращениям. Освобождаются от него, превращая в метан: СО + 3Н2 = СН4 + Н2О. 7. Синтез аммиака (после всех стадий получена чистая азотоводородная смесь; примесь СН4, полученная в предыдущей стадии, мала): 3Н2 + N2 = 2NН3. Функциональная схема (рис.1) строится на основе химической и наглядно отражает основные стадии химико-технологического процесса и их взаимосвязи. Каждая из них представлена прямоугольником, линии между ними – связи. Структурную и операторную схемы производства аммиака иллюстрирует рис. 2.
Рис. 1. Функциональная схема производства аммиака
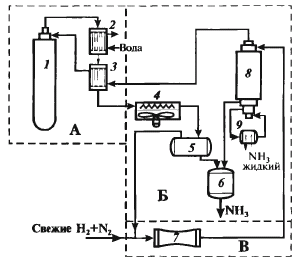
Рис. 2. Структурная (а) и операторная (б) схемы синтеза аммиака На технологической схеме показывают элементы системы, порядок их соединения и последовательность технологических операций. В технологической схеме каждый элемент (агрегат, аппарат, машина) имеетобщепринятое изображение, соответствующее его внешнему виду. Связи изображены обычно линиями со стрелками или даже в виде трубопроводов. Нередко расположение аппаратов соответствует их примерной расстановке в цехе. На технологической схеме кратко могут быть приведены данные о параметрах процесса. Несколько сокращенная технологическая схема синтеза аммиака приведена на рис. 3. Азотоводородная смесь поступает в реактор 1. Нагретая за счет теплоты экзотермической реакции прореагировавшая реакционная смесь охлаждается в трех теплообменниках. В первом из них (2) газ охлаждается водой – частично используется теплота реакции. В теплообменнике 3 подогревается газ, направляемый в реактор. Окончательное охлаждение происходит в воздушном холодильнике 4. Это наиболее простое и безопасное решение. Если охлаждать водой, вода может загрязняться, и необходимо создать сложную замкнутую систему водооборота, работающую на чуть теплой воде.
В охлажденном газе конденсируется аммиак (частично), и его отделяют в сепараторе 5. Жидкий аммиак собирается в сборнике 6 как продукт. Охлаждение до температуры окружающей среды недостаточно для полного выделения аммиака, и газ из сепаратора направляется в конденсационную колонну 8. В ней газ охлаждается до – (2 ¸ 3) °С, так что в нем остается 3–5 % аммиака. Охлаждение осуществляют за счет испарения жидкого аммиака в испарителе 9 (подобно аммиачному холодильнику). Испаритель может быть конструктивно совмещен с конденсационной колонной. В ней же аммиакотделяют от газа и направляют в сборник. Холодный газ затем подогревают в теплообменнике 3 и возвращают в колонну синтеза 1. Обеспечивают циркуляцию потока циркуляционным компрессором 7. Перед ним в циркулирующий реакционный газ добавляют свежую азотоводородную смесь. Отметим наглядность отображения конкретного производства, дающую почти осязаемое представление о нем. Технологические схемы входят в проектную и техническую документацию каждого производства.
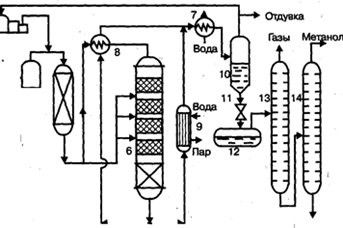
Рис. 3. Технологическая схема синтеза аммиака: 1 – колонна (реактор) синтеза NH3; 2 – водяной холодильник; 3 – теплообменник; 4 – воздушный холодильник; 5 – сепаратор; 6 – сборник аммиака; 7 – циркуляционный компрессор; 8 – конденсационная колонна; 9 – испаритель. Химико-технологическая система (ХТС)производства метанола. Основным аппаратом в синтезе метанола служит реактор – контактный аппарат, конструкция которого зависит, главным образом, от способа отвода тепла и принципа осуществления процесса синтеза. В современных технологических схемах используются реакторы трех типов: · - трубчатые реакторы, в которых катализатор размещен в трубах, через которые проходит реакционная масса, охлаждаемая водным конденсатом, кипящим в межтрубном пространстве; · - адиабатические реакторы, с несколькими слоями катализатора, в которых съем тепла и регулирование температуры обеспечивается подачей холодного газа между слоями катализатора; · - реакторы, для синтеза в трехфазной системе, в которых тепло отводится за счет циркуляции жидкости через котел-утилизатор или с помощью встроенных в реактор теплообменников. Вследствие большого объема производства и весьма крупных капитальных затрат в производстве метанола сейчас используют все три типа технологических процессов. На рис. 4 представлена технологическая схема производства метанола при низком давлении на цинк-медь-алюминиевом катализаторе из синтез-газа состава: Hg - 67%, СО - 22%, СО2 - 9% -объемных, полученного конверсией метана, производительностью 400 тыс. т в год. Очищенный от сернистых соединений синтез-газ сжимается в компрессоре 1 до давления 5-9 МПа, охлаждается в холодильнике 3 и поступает в сепаратор 4 для отделения сконденсировавшейся воды. Пройдя сепаратор, синтез-газ смешивается с циркуляционным газом, который поджимается до рабочего давления в компрессоре 2. Газовая смесь проходит через адсорбер.
Рис. 4. Технологическая схема производства метанола при низком давлении: 1 - турбокомпрессор, 2 - циркуляционный компрессор, 3, 7 - холодильники, 4 - сепаратор, 5 - адсорбер, 6 - реактор адиабатического действия, 8 - теплообменник, 9 - котел-утилизатор, 10 - сепаратор, 11 - дроссель, 12 - сборник метанола-сырца, 13, 14 - ректификационные колонны Циркуляционый газ 5, где очищается от пентакарбонила железа, образовавшегося при взаимодействии оксида углерода(II) с материалом аппаратуры, и разделяется на два потока. Один поток подогревают в теплообменнике 8 и подают в верхнюю часть реактора 6, а другой поток вводят в реактор между слоями катализатора для отвода тепла и регулирования температуры процесса. Пройдя реактор, реакционная смесь при температуре около 300°С также делится на два потока. Один поток поступает в теплообменник 8, где подогревает исходный синтез-газ, другой поток проходит через котел-утилизатор 9, вырабатывающий пар высокого давления. Затем, потоки объединяются, охлаждаются в холодильнике 7 и поступают в сепаратор высокого давления 10, в котором от циркуляционного газа отделяется спиртовой конденсат. Циркуляционный газ дожимается в компрессоре 2 и возвращается на синтез. Конденсат метанола-сырца дросселируется в дросселе 11 до давления близкого к атмосферному и через сборник 12 поступает на ректификацию. В ректификационной колонне 13 от метанола отгоняются газы и. диметиловый эфир, которые также сжигаются. Полученный товарный метанол с выходом 95% имеет чистоту 99,95%. На рис. 5. приведена технологическая схема производства метанола по трехфазному методу на медь-цинковом катализаторе из синтез-газа, полученного газификацией каменного угля, производительностью 650 тыс. т в год.
Рис. 5. Технологическая схема производства метанола в трехфазной системе: 1 - компрессор, 2 - циркуляционный компрессор, 3,9 - насосы, 4 -реактор кипящего слоя, 5,6 - теплообменники, 7 - холодильник-конденсатор, 8 - сепаратор, 10 - котел-утилизатор. Очищенный от соединений серы синтез-газ сжимается в компрессоре 1 до давления 3-10 МПа, подогревается в теплообменнике 5 продуктами синтеза до 200-280°С, смешивается с циркуляционным газом и поступает в нижнюю часть реактора 4. Образовавшаяся в реакторе парогазовая смесь, содержащая до 15% метанола, выходит из верхней части реактора, охлаждается последовательно в теплообменниках 5 и 6 и через холодильник-конденсатор 7 поступает в сепаратор 8, в котором от жидкости отделяется циркуляционный газ. Жидкая фаза разделяется в сепараторе на два слоя: углеводородный и метанольный. Жидкие углеводороды перекачиваются насосом 9 в реактор, соединяясь с потоком углеводородов, проходящих через котел-утилизатор 10. Таким образом жидкая углеводородная фаза циркулирует через реактор снизу вверх, поддерживая режим кипящего слоя тонкодисперсного катализатора в нем, и одновременно обеспечивая отвод реакционного тепла. Метанол-сырец из сепаратора 8 поступает на ректификацию или используется непосредственно как топливо или добавка к топливу. Разработанный в 70-х годах трехфазный синтез метанола используется в основном, для производства энергетического продукта. В качестве жидкой фазы в нем применяются стабильные в условиях синтеза и не смешивающиеся с метанолом углеводородные фракции нефти, минеральные масла, полиалкилбензолы. К указанным выше преимуществам трехфазного синтеза метанола следует добавить простоту конструкции реактора, возможность замены катализатора в ходе процесса, более эффективное использование теплового эффекта реакции. Вследствие этого установки трехфазного синтеза более экономичны по сравнению с традиционными двухфазными как высокого так и низкого давления. В таблице 1 приведены показатели работы установок трех- и двухфазного процесса одинаковой производительности 1800 т/сут.Таблица 1. Показатели работы установок синтеза метанола
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 151; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.93.136 (0.06 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||