Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гальванические элементы. Коррозия металловСодержание книги
Поиск на нашем сайте
Лабораторная работа № 1 ЭЛЕКТРОЛИЗ
Цель работы Изучение процессов, происходящих при электролизе водных растворов электролитов.
Оборудование и реактивы Источник постоянного электрического тока, электролизеры, кристаллизатор, медный и графитовые электроды, пробки, пробирки, промывалка, секундомер, спиртовка, спички, химические стаканы. Медная и никелевая пластинки, медная проволока; иод-крахмальная бумага; дистиллированная вода, растворы: хлороводородная кислота HCl (2 М), гидроксид натрия NaOH (15%-ный), хлорид натрия NaCl (насыщ.), сульфат никеля (II) NiSO4 (0,3 М) и 0,5 М сульфат меди (II) CuSO4, иодид калия KI, сульфат натрия Na2SO4; индикаторы: метиловый оранжевый, фенолфталеин.
Экспериментальная часть [1]
Опыт 1. Электролиз раствора хлорида натрия Соберите электролизер с насыщенным раствором NaCl на инертных электродах по схеме (рис. 6) и подключите к источнику электрического тока, отметьте время полного заполнения пробирки газом с катода. Подтвердите качественный состав выделившегося на катоде газа ______, собранного над водой – поднося пробирку с газом (строго вертикально и вверх дном) к горящей лучине или спиртовке. Выделяющийся на аноде газ ______ пропустите в раствор KI с иод-крахмальной бумагой. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Вычислите массовую долю выхода (η) водорода от теоретически возможного (%) по формуле: η = mпрак ∙100% / mтеор = ______________________________. Вычисление практической массы (m прак) проводится исходя из практического объема газа, полученного за время проведения эксперимента: mпрак = M ∙ Vпрак / Vm, ____________________________________________________________, где М – молярная масса полученного вещества; Vпрак – объем полученного вещества; Vm – молярный объем газа, равный 22,4 моль/л. Вычисление теоретической массы (m теор) получаемых веществ проводится по формуле: Mтеор= МЭ∙I∙τ / F = ________________________________________, где М Э – молярная масса эквивалента получаемого вещества (= молярная масса полученного вещества / число принятых или отданных электронов; г/моль); I – сила тока, при которой осуществляется процесс (А); τ – время электролиза (с); F – постоянная Фарадея (96485 Кл/моль).
Опыт 2. Электролиз раствора сульфата натрия В U-образную трубку налейте 0,5 М раствора Na2SO4 и добавьте в оба колена несколько капель раствора метилового оранжевого. Опустите инертные электроды и присоедините их к источнику постоянного тока. Пропускайте ток в течение 5–10 мин. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Опыт 3. Электролиз раствора иодида калия В U-образную трубку налейте 0,5 М раствор KI и добавьте в оба колена несколько капель раствора фенолфталеина. Опустите инертные электроды и присоедините их к источнику постоянного тока. Пропускайте ток в течение 5–10 мин. Объясните изменение цвета раствора около катода и анода. Внесите в околоанодное пространство иод-крахмальную бумагу. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Опыт 4. Электролиз раствора сульфата меди ( II) В U-образную трубку налейте 0,5 М раствор CuSO4 и добавьте в околоанодное пространство несколько капель раствора метилового оранжевого. Опустите инертные электроды и присоедините их к источнику постоянного тока. Пропускайте ток в течение 5–10 мин. Объясните появление на катоде красного налета меди. Проделайте данный опыт, используя растворимый медный анод. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Опыт 5. Электролитическое получение никеля (никелирование) Подготовка к никелированию: - механическая обработка: тонкую медную пластинку (длиной 3–4 см и шириной 1 см) с прикрепленной к одному концу медной проволокой тщательно очистите наждачной бумагой; - обезжиривание: опустите очищенную пластинку на 1–2 минуты в 15%-ный раствор щелочи, а затем, не касаясь руками пластинки, промойте ее дистиллированной водой из промывалки; - травление: опустите обезжиренную пластинку на 1–2 минуты в 2 М раствор HCl для освобождения поверхности металла от оксидов, а затем, не касаясь руками пластинки, промойте ее дистиллированной водой из промывалки и положите на фильтровальную бумагу. Прибор для электролиза: в химический стакан налейте электролит и опустите электроды, в качестве катода используйте предварительно обезжиренную и протравленную в соляной кислоте медную пластинку, в качестве анода – никелевую пластинку. Электролиз проводите при комнатной температуре, плотности тока 0,3 А/дм2, напряжении 3,5 В и расстоянии между электродами 1,5 см. Используйте электролит для никелирования: в 100 мл H2O растворяют 5 г NiSO4 и 1,5 г H3BO3. Составьте уравнения электродных процессов. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Вывод: ___________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________
Пример Напишите электронные уравнения реакций, протекающих на электродах при электролизе водного раствора сульфата меди(II). Какая масса меди выделится на катоде и какой объем кислорода выделится на аноде в течение 1 часа и силе тока равной 4А?
Решение
Контрольные задания 1. Составьте уравнения процессов, протекающих при электролизе расплавов а) NaOH, б) NiCl2, в) K2S с инертными электродами. 2. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) H2SO4, б) Pb(NO3)2 с платиновыми электродами. 3. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) BaCl2, б) Ni(NO3)2 с угольными электродами. 4. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) FeCl3, б) Ca(NO3)2 с инертным анодом. 5. Составить схемы электролиза водного раствора хлорида цинка, если: а) анод цинковый; б) анод угольный. 6. Составить схемы электролиза водного раствора хлорида меди, если: а) анод медный; б) анод угольный. 7. Раствор содержит ионы Fe2+, Ag+, и Pb2+ в одинаковой концентрации. В какой последовательности эти ионы будут выделяться при электролизе, если напряжение достаточно для выделения любого металла? 8. При электролизе растворов CuCl2 на аноде выделилось 560 мл газа (н. у.). Найти массу меди, выделившейся на катоде. 9. Какие вещества и в каком количестве выделятся при пропускании тока силой 10 А в течение 5 минут через расплав хлорида магния? 10. Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6А через раствор нитрата серебра в течение 30 мин. 11. Сколько времени потребуется для полного разложения 2 молей воды током силой 2А? 12. Как электролитически получить LiОН из соли лития? Какое количество электричества необходимо для получения 1т LiОН? Составить схемы электродных процессов. 13. Найти объем кислорода (н. у.), который выделится при пропускании тока силой 6 А в течение 30 мин через водный раствор КОН. 14. Найти объем водорода (условия нормальные), который выделится при пропускании тока силой в 3 А в течение 1 ч через водный раствор серной кислоты. 15. Какое количество электричества потребуется для выделения из раствора: а) 2 г водорода; б) 2 г кислорода? 16. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) сульфида натрия, б) бромида алюминия с инертными электродами. 17. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) нитрата серебра, б) карбоната натрия с инертными электродами. 18. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) сульфида лития, б) нитрита калия с инертными электродами. 19. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) нитрата хрома (III), б) азотной кислоты с инертными электродами. 20. Написать уравнения электродных процессов, протекающих при электролизе водных растворов а) гидроксида калия, б) хлороводородной кислоты с инертными электродами. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Лабораторная работа № 2 Лабораторная работа № 3 Часть 1. Хром. Марганец. Цель работы Изучение способов получения и свойств d-элементов побочных подгрупп шестой и седьмой групп: хром, марганец
Оборудование и реактивы Пробирки, пробиркодержатель, спиртовка, спички, лабораторный штатив, воронка, фильтровальная бумага Хлорид марганца (II) MnCl2(р-р), 10%-ный пероксид водорода H2O2, 2М серная кислота (разб) H2SO4, 2М гидроксид натрия NaOH (р-р), сульфида натрия Na2S (р-р), оксид марганца (IV) MnO2 (тв), сульфат железа (II) FeCl2 (р-р), роданида (тиоцианата) аммония NH4CN (р-р), серная кислота H2SO4(конц.), соляная кислота HCl (конц), сульфит натрия Na2SO3 (тв), перманганат калия KMnO4 (р-р), уксусная кислота CH3COOH(разб), бромид калия KBr (р-р), дихромат аммония (NH4)2Cr2O7 (тв.), хлорида хрома (III) CrCl3 (р-р), сульфид аммония (NH4)2S (р-р), соляная кислота HCl (разб), 3%-ного пероксид водорода Н2О2, бромная вода, цинка металлический, бензин, бихромата калия K2Cr2О7(р-р), этиловый спирт C2H5OH, иодид калия KI (р-р), р-р крахмала, хромат калия KCrO4 (р-р), сульфит натрия Na2SO3 (р-р), вода H2O. Экспериментальная часть [3] Внешние признаки вещества в зависимости от степени окисления
Опыт 1. Получение и свойства гидроксида марганца (II) В четыре пробирки внесите по 1мл раствора хлорида марганца (II) MnCl2 и прибавьте по 1мл 2М раствора гидроксида натрия NaOH. Отметьте цвет осадка в первый момент. Осадок в первой пробирке перемешайте встряхиванием и оставьте в штативе на некоторое время. В остальные пробирки добавьте в-ва по таблице.
Опыт 2. Получение сульфида марганца (II) и его окисление В пробирку внесите 1мл раствора хлорида марганца (II) MnCl2 и добавьте 1мл раствора сульфида натрия Na2S. Отметьте цвет осадка и напишите уравнение реакции ________________________________________________________________________________ Обработайте осадок несколькими каплями 10%-ного раствора пероксида водорода. Как изменяется цвет осадка? Напишите уравнение реакций _____________________________ ________________________________________________________________________________ Опыт 3. Окисление соединений марганца (II) В пробирку внесите немного 0,5М раствора сульфата марганца (II) MnSO4 и добавьте 0,1М раствор перманганата калия. Содержимое пробирки встряхните. Опустите в пробирку синюю лакмусовую бумажку или испытайте реакцию среды универсальным индикатором___________________________. Обратите внимание на цвет образовавшегося осадка и напишите уравнение реакции.______________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Опыт 4. Окислительные свойства оксида марганца (IV) 4.1. В пробирку внесите немного оксида марганца (IV) MnO2, прибавьте 2мл 2М раствора серной кислоты H2SO4 и 1мл раствора сульфата железа (II) FeCl2 (или немного кристаллической соли Мора). _____________________________________________________________ ________________________________________________________________________________ Содержимое пробирки перемешайте встряхиванием, дайте отстояться. Раствор аккуратно слейте в чистую пробирку и добавьте к нему несколько капель раствора роданида (тиоцианата) аммония NH4CN.__________________________________________________________ ________________________________________________________________________________ 4.2. К нескольким крупинкам оксида марганца (IV) MnO2 прилейте немного концентрированной серной кислоты H2SO4. Осторожно нагрейте пробирку со смесью до выделения газа._____________________________________________________________________________ ________________________________________________________________________________ 4.3. Насыпьте в пробирку немного диоксида марганца, прилейте 1мл концентрированной соляной кислоты HCl. Слегка подогрейте пробирку. Наблюдайте выделение газа, который определите по цвету и запаху (соблюдайте осторожность!).__________________________ ________________________________________________________________________________ ________________________________________________________________________________
Опыт 5. Влияние среды на окислительные свойства перманганата калия 5.1. В три пробирки внесите по 1мл раствора перманганата калия KMnO4. В первой пробирке раствор подкислите 2М серной кислотой H2SO4 (2 капли), во вторую добавьте столько же воды, а в третью – 2 капли 20%-ного раствора щелочи NaOH. В каждую пробирку добавьте кристаллического сульфита натрия Na2SO3 до изменения первоначальной окраски раствора. Отметьте цвет полученных растворов и осадка и напишите уравнения______________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 5.2. Налейте в две пробирки по 2-3мл раствора бромида калия KBr, прибавьте разбавленную серную кислоту H2SO4 – в первую и разбавленную уксусную кислоту CH3COOH– во вторую пробирку. В каждую пробирку добавьте по 2мл раствора KMnO4. _________________ ________________________________________________________________________________ ________________________________________________________________________________ Отметьте, одновременно ли наблюдается изменение окраски раствора в обеих пробирках. Как pH среды влияет на скорость процесса?_______________________________________ ________________________________________________________________________________ Опыт 6. Получение и свойства оксида хрома ( III) Насыпать в пробирку немного измельченного дихромата аммония (NH4)2Cr2O7 и закрепить ее наклонно в штативе. Под пробирку положить лист бумаги. Нагреть верхний слой соли до начала реакции и затем нагревание прекратить. ________________________________ ________________________________________________________________________________ Полученный порошок разделить на две части и подействовать водой H2O и разбавленной серной кислотой H2SO4.________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________
Опыт 7. Получение и свойства гидроксида хрома ( III) В пробирку с раствором хлорида хрома (III) CrCl3 по каплям прибавить раствор гидроксида натрия NaOH до образования осадка. Отметить цвет осадка, составить уравнение реакции. ____________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________
Разделить осадок на две пробирки. В одну из них добавить разбавленную серную кислоту H2SO4, в другую – избыток щелочи NaOH_______________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Лабораторная работа №4 Синтез и свойства полимеров Цель работы Изучение синтеза и некоторых физических и химических свойств полимеров. Распознавание пластмасс и волокон. Оборудование и реактивы Водяная баня, пробки с газоотводными трубками, пробирки, пробиркодержатель, пробки, спиртовка, спички, стакан, стеклянная палочка, фарфоровые чашки, предметное стекло, асбестовая сетка. Набор плстмасс: полиэтилен, поливинилхлорид, полистирол, капрон, аминопласт, полиметилметакрилат, целлулоид; набор волокон: вискозное, ацетатное, нитрон, хлорин, лавсан, хлопок, шерсть, шелк, капрон; азотная кислота HNO3 (конц.), серная кислота H2SO4 (конц.), гидроксид натрия NaOH (10% и 0,1 н.), нитрат серебра AgNO3, формалин, соляная кислота HCl (конц.),. фенол (тв.), фенолформальдегид (ж), этанол C2H5OH, раствор перманганата калия KMnO4, ацетон, бензол, дихлорэтан. Экспериментальная часть [5] При изучении свойств пластмасс и волокон пользуйтесь таблицами приложений. Опыт 1. Полимеризация и деполимеризация альдегида В фарфоровую чашку помещают 4 – 5 мл формалина и осторожно выпаривают на водяной бане. Что представляет собой твердый остаток? Остаток нагревают на открытом огне (вытяжной шкаф). Запишите наблюдения и дайте объяснения происходящим изменениям с помощью уравнений реакций.______________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________
Опыт 2. Получение фенолоформальдегидных смол В пробирку помещают несколько кристаллов фенола и 1 мл раствора формальдегида. Смесь нагревают до растворения фенола. ____________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Через 3 минуты к раствору добавляют 5 капель концентрированной соляной кислоты и продолжают нагревание до расслоения смеси. ________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Пробирку помещают в стакан с холодной водой. После образования четкой границы между слоями сливают воду и быстро выливают смолу на предметное стекло. Испытывают образовавшуюся смолу на растворимость в спирте. Небольшое количество смолы нагревают в фарфоровой чашке до затвердевания. Испытывают растворимость в спирте затвердевшей смолы._______________________________________________________
Опыт 3. Свойства полиэтилена 1.1. Кусочек полиэтиленовой трубки или другого изделия (но не пленки) положите на проволочную сетку и осторожно нагрейте. При помощи стеклянной палочки измените форму изделия.________________________________________________________________________ ________________________________________________________________________________
Дайте кусочку полиэтилена остыть и еще раз попытайтесь изменить его форму, меняется ли форма?__________________________________________________________________________ 1.2.Кусочек полиэтилена при помощи тигельных щипцов внесите в пламя и подожгите его. Каким пламенем горит, образует ли капли, вытягивается в нити?_____________________ ________________________________________________________________________________ 1.3. Несколько мелких кусочков полиэтилена поместите в пробирку с раствором перманганата калия. Содержимое пробирки подогрейте.___________________________________ ________________________________________________________________________________ ________________________________________________________________________________ 1.4. Несколько кусочков полиэтилена поместите в пробирку: а) с концентрированной серной кислотой H2SO4; б) с концентрированным раствором азотной кислоты HNO3; в) с разбавленным раствором гидроксида натрия NaOH. Все пробирки осторожно нагрейте. а)_______________________________________________________________________________ б)_______________________________________________________________________________ в)_______________________________________________________________________________ Опыт 4. Определение хлора в поливинилхлориде 4.1.Внесите кусочек поливинилхлорида в пламя, обратите внимание на запах продуктов горения и цвет пламени._______________________________________________________ 4.2.Поместите несколько кусочков поливинилхлорида в пробирку, закройте ее пробкой с газоотводной трубкой, конец которой опустите в другую пробирку с 1—2 мл раствора нитрата серебра. Конец газоотводной трубки держите в 0,5—1.0 см от поверхности раствора. Содержимое первой пробирки сильно нагрейте._______________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Опыт 5. Распознавание пластмасс и волокон Прежде чем приступить к выполнению практической работы, ознакомьтесь со свойствами пластмасс и волокон (табл.). После этого получите задание. Распознавание пластмасс следует начать с внешнего осмотра, а затем перейти к исследованию их отношения к нагреванию и горению. Потом испытывают действие на них растворителей. Распознавание волокон начинают с их сжигания. При этом прослеживают, с какой скоростью происходит горение, исследуют запах продуктов разложения, свойства остатка, который образуется после сгорания. Затем проверяют действие на волокна кислот, щелочей и растворителей. 5.1.В четырех пакетах находятся пластмассы: I вариант) поливинилхлорид, аминопласт, целлулоид и фенопласт; II вариант) полиэтилен, полистирол, полиметилметакрилат и капрон. Определите, какая пластмасса находится в каждом из пакетов. Зполните таблицу Вариант ______
5.2.В четырех пакетах находятся волокна: I вариант) натуральный шелк (или шерсть), вискозное волокно, нитрон и лавсан; II вариант) хлопчатобумажная ткань, ацетатное волокно, хлорин и капрон. Определите, какое вещество находится в каждом из пакетов.
Вывод: _________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Пример Перечислите основные типы полимеров и приведите примеры. Решение
Контрольные задания 1. Что общего и различного в свойствах пластичности и эластичности? Чем это объясняется? 2. Чем различаются по строению макромолекулы каучуков и волокон? И как это оказывает влияние на их свойства? Показать на примере волокон и каучуков, при каких условиях может возрастать кристалличность полимеров. 3. Проведите классификацию изученных полимеров по известным вам признакам. 4. Приведите примеры веществ–мономеров, используемых в реакции полимеризации. Укажите общее в их строении и свойствах. 5. Приведите примеры веществ–мономеров, используемых в реакции поликонденсации. Укажите общее в их строении и свойствах. 6. Приведите примеры веществ-мономеров, используемых в реакции сополимеризации. 7. В чем принципиальная разница химических процессов полимеризации, сополимеризации и поликонденсации? 8. Какие признаки положены в основу классификации ВМС? Ответ конкретизируйте. 9. Какие характеристики являются определяющими в свойствах ВМС? 10. Какие реакции лежат в основе получения полимеров? Приведите примеры. 11. Напишите уравнения реакций получения поливинилхлорида. 12. Напишите уравнение реакции получения полипропилена. 13. Напишите уравнение реакции получения фенол-формальдегидной смолы. 14. Какие соединения называют аминами? Составьте схему поликонденсации адипиновой кислоты и гексаметилендиамина. Назовите образовавшийся полимер. 15. Напишите схему строения синтетического каучука, полученного из 2,3-диметилбутадиена, считая, что он представляет собой продукт 1,4-полимеризации. 16. Какой путь получения синтетического каучука разработал С. В. Лебедев? Приведите уравнения реакций. 17. Напишите схему строения бутадиен-стирольного каучука, считая для простоты, что он представляет собой регулярный полимер, в котором на одно стирольное звено приходится три бутадиеновых, и что бутадиен реагирует только в положениях 1,4. 18. Что такое хлоропреновый каучук? Как синтезировать необходимый для его получения мономер? 19. Рассчитайте содержание хлора (%) в хлоропреновом каучуке. 20. Напишите схему строения бутадиен-нитрильного каучука, считая, что он представляет собой регулярный полимер, в котором на один остаток акрилонитрила приходится три остатка бутадиена, и что бутадиен реагирует только в положениях 1,4. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ПРИЛОЖЕНИЯ
Греческий алфавит
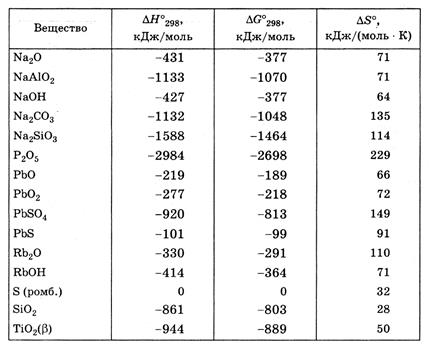
4. Произведение растворимости (ПР) малорастворимых веществ при 25 ° C
В водных растворах
Лабораторная работа № 1 ЭЛЕКТРОЛИЗ
Цель работы Изучение процессов, происходящих при электролизе водных растворов электролитов.
Оборудование и реактивы Источник постоянного электрического тока, электролизеры, кристаллизатор, медный и графитовые электроды, пробки, пробирки, промывалка, секундомер, спиртовка, спички, химические стаканы. Медная и никелевая пластинки, медная проволока; иод-крахмальная бумага; дистиллированная вода, растворы: хлороводородная кислота HCl (2 М), гидроксид натрия NaOH (15%-ный), хлорид натрия NaCl (насыщ.), сульфат никеля (II) NiSO4 (0,3 М) и 0,5 М сульфат меди (II) CuSO4, иодид калия KI, сульфат натрия Na2SO4; индикаторы: метиловый оранжевый, фенолфталеин.
Экспериментальная часть [1]
Опыт 1. Электролиз раствора хлорида натрия Соберите электролизер с насыщенным раствором NaCl на инертных электродах по схеме (рис. 6) и подключите к источнику электрического тока, отметьте время полного заполнения пробирки газом с катода. Подтвердите качественный состав выделившегося на катоде газа ______, собранного над водой – поднося пробирку с газом (строго вертикально и вверх дном) к горящей лучине или спиртовке. Выделяющийся на аноде газ ______ пропустите в раствор KI с иод-крахмальной бумагой. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Вычислите массовую долю выхода (η) водорода от теоретически возможного (%) по формуле: η = mпрак ∙100% / mтеор = ______________________________. Вычисление практической массы (m прак) проводится исходя из практического объема газа, полученного за время проведения эксперимента: mпрак = M ∙ Vпрак / Vm, ____________________________________________________________, где М – молярная масса полученного вещества; Vпрак – объем полученного вещества; Vm – молярный объем газа, равный 22,4 моль/л. Вычисление теоретической массы (m теор) получаемых веществ проводится по формуле: Mтеор= МЭ∙I∙τ / F = ________________________________________, где М Э – молярная масса эквивалента получаемого вещества (= молярная масса полученного вещества / число принятых или отданных электронов; г/моль); I – сила тока, при которой осуществляется процесс (А); τ – время электролиза (с); F – постоянная Фарадея (96485 Кл/моль).
Опыт 2. Электролиз раствора сульфата натрия В U-образную трубку налейте 0,5 М раствора Na2SO4 и добавьте в оба колена несколько капель раствора метилового оранжевого. Опустите инертные электроды и присоедините их к источнику постоянного тока. Пропускайте ток в течение 5–10 мин. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Опыт 3. Электролиз раствора иодида калия В U-образную трубку налейте 0,5 М раствор KI и добавьте в оба колена несколько капель раствора фенолфталеина. Опустите инертные электроды и присоедините их к источнику постоянного тока. Пропускайте ток в течение 5–10 мин. Объясните изменение цвета раствора около катода и анода. Внесите в околоанодное пространство иод-крахмальную бумагу. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Опыт 4. Электролиз раствора сульфата меди ( II) В U-образную трубку налейте 0,5 М раствор CuSO4 и добавьте в околоанодное пространство несколько капель раствора метилового оранжевого. Опустите инертные электроды и присоедините их к источнику постоянного тока. Пропускайте ток в течение 5–10 мин. Объясните появление на катоде красного налета меди. Проделайте данный опыт, используя растворимый медный анод. ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Опыт 5. Электролитическое получение никеля (никелировани |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 401; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.224.105 (0.01 с.) |


 Опыты проводятся в электролизере, состоящем из U-образной трубки (в опыте № 1 с отростками, в опытах № 2–4 без отростков); графитовые или соответствующие электроды из металлов, закрепленные в резиновые пробки неплотно (кроме опыта № 1 – плотно) вставляются в электролизер, который заполняется раствором электролита на 1/2 его объема. По окончании опытов электроды тщательно промойте водой.
Опыты проводятся в электролизере, состоящем из U-образной трубки (в опыте № 1 с отростками, в опытах № 2–4 без отростков); графитовые или соответствующие электроды из металлов, закрепленные в резиновые пробки неплотно (кроме опыта № 1 – плотно) вставляются в электролизер, который заполняется раствором электролита на 1/2 его объема. По окончании опытов электроды тщательно промойте водой.