Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Материальный баланс массообменных процессовСодержание книги
Поиск на нашем сайте
ОСНОВЫ МАССОПЕРЕДАЧИ Ряд процессов химической технологии основывается на явлениях массообмена. (Массообменные процессы обычно используют для разделения гомогенных и гетерогенных систем). К массообменным процессам относятся: Абсорбция – избирательное поглощение газов или паров жидким поглотителем (абсорбентом). Она связана с переходом вещества из газовой или паровой фазы в жидкую. Ректификация – разделение жидкой смеси на компоненты в результате многократного взаимного обмена при противоточном взаимодействии потоков жидкости и пара. Она связана с переходом вещества из жидкой фазы в паровую (для НКК) и наоборот (для ВКК). Сушка – удаление влаги из твердых влажных материалов путем ее испарения. Она связана с переходом влаги из твердого влажного материала в паровую или газовую фазу. Адсорбция (десорбция) – избирательное поглощение газов, паров или растворенных в жидкости веществ пористым поглотителем – адсорбентами. Она связана с переходом вещества из газовой, паровой или жидкой фаз в твердую. Экстракция – извлечение растворенного в одной жидкости вещества другой жидкостью. Она связана с переходом вещества из одной жидкой фазы в другую. Кристаллизация (растворение) – выделение твердой фазы в виде кристаллов из растворов или расплавов. Она связана с переходом вещества из жидкой фазы в твердую (или наоборот). Общим для всех этих процессов является переход вещества из одной фазы в другую, то есть перенос массы в направлении достижения равновесия. Таким образом, массопередачей называется процесс перехода вещества (или нескольких веществ) из одной фазы в другую в направлении достижения равновесия. Подобно теплопередаче, массопередача представляет собой сложный процесс, включающий перенос массы в пределах одной фазы, перенос через поверхность раздела фаз и перенос в пределах другой фазы. Аналогично тепловым процессам, перенос вещества из объема одной фазы к границе раздела с другой фазой или в обратном направлении называется массотдачей. Поскольку перенос вещества внутри фазы происходит путем диффузии, процессы массопередачи называются также диффузионными процессами. В большинстве процессов массопередачи участвуют три вещества и две фазы, которые являются носителями распределяемого вещества:
1) распределяющее вещество, составляющее первую фазу; 2) распределяющее вещество, составляющее вторую фазу; 3) распределяемое вещество, переходящее из одной фазы в другую. Массообменные процессы, как правило, обратимы, то есть переход распределяемого вещества может совершаться в любом направлении при отсутствии равновесия между фазами. Пусть вещество «М» находится только в газовой фазе «G» и имеет концентрацию У. В жидкой фазе «L» концентрацию Х = 0. Если распределяющие фазы привести в соприкосновение, то распределяемое вещество «М» начнет переходить из фазы «G» в фазу «L». При этом, естественно У уменьшается, а Х возрастает. С момента появления вещества «М» в фазе «L» начнется неизбежно и обратный переход распределяемого вещества. Скорость обратного перехода будет увеличиваться по мере возрастания концентрации Х и через определенный промежуток времени прямая и обратная скорости выравниваются. Устанавливается динамическое равновесное состояние, когда нет явного переноса массы из одной фазы в другую. Концентрации распределяемого вещества в этом состоянии называются равновесными (предельными): У* и Х*. Очевидно, что любой неравновесной концентрации Х соответствует равновесная концентрация У*, и наоборот: У* = f (X); X * = f (У). Равновесие между фазами часто представляют графически на У – Х –диаграмме. где У и Х – (относительные концентрации (кг распределяемого вещества/кг носителя).
Конкретные уравнения условий равновесия будут рассмотрены при описании отдельных процессов. 1. Чтобы определить скорость процесса в данных условиях и предусмотреть такие условия, чтобы процесс проходил с достаточной скоростью. Пусть в равновесии m частиц распределяемого вещества переходит из фазы «G» в фазу «L» и столько же обратно. Увеличим количество частиц распределяемого вещества на величину «n» в фазе «G». Скорость перемещения частиц в фазу «L» будет определяться не общим числом частиц m + n, а лишь избыточным «n» по отношению к равновесному. Скорость перехода распределяемого вещества из одной фазы в другую пропорциональна разности между фактической концентрацией эго вещества в данной фазе и равновесной концентрацией в ней же.
Переход вызван этой разностью а, следовательно, она является движущей силой процесса. По кинетической кривой Этот метод более совершенен, т.к. основан на построении на у-х диаграмме вспомогательной, так называемой кинетической кривой, которая учитывает фактическую степень достижения равновесия на каждой отдельной тарелке. Это позволяет графическим способом сразу найти реальное число тарелок. Выделим на тарелке элемент dF.
Жидкость полностью перемешана на элементе dF. Тогда материальный баланс выразится (по газовой фаз).
Отсюда: Считая, что Получаем: (1-) Вычитая из единицы обе части уравнения:
Это выражение представляет собой локальный КПД тарелки, характеризующий степень достижения равновесия в данном месте тарелки:
Аналогичное выражение можно записать для всей тарелки при условии, что газ полностью перемешан на тарелке с жидкостью.
Это КПД по Мерффи или эффективность тарелки. Отношение действительного изменения концентрации в газовой фазе к предельно возможному (при равновесии уходящего пара с жидкостью). Так как на тарелке существует направленный поток жидкости, что приводит к изменению гидравлических условий и движущей силы процесса.
При допущении об идеальном перемешивании, т.е. при полном перемешивании E = 1- Этой формулой и пользуются для расчета, а для учета перемешивания и каплеуноса вводят соответствующие поправочные коэффициенты. Для раскрытия физического смысла показателя степени. Запишем уравнение материального для всей тарелки
Отсюда: Обычно коэффициент массопередачи относят к единице рабочей площади тарелки:
Или ОСНОВЫ МАССОПЕРЕДАЧИ Ряд процессов химической технологии основывается на явлениях массообмена. (Массообменные процессы обычно используют для разделения гомогенных и гетерогенных систем). К массообменным процессам относятся: Абсорбция – избирательное поглощение газов или паров жидким поглотителем (абсорбентом). Она связана с переходом вещества из газовой или паровой фазы в жидкую. Ректификация – разделение жидкой смеси на компоненты в результате многократного взаимного обмена при противоточном взаимодействии потоков жидкости и пара. Она связана с переходом вещества из жидкой фазы в паровую (для НКК) и наоборот (для ВКК). Сушка – удаление влаги из твердых влажных материалов путем ее испарения. Она связана с переходом влаги из твердого влажного материала в паровую или газовую фазу. Адсорбция (десорбция) – избирательное поглощение газов, паров или растворенных в жидкости веществ пористым поглотителем – адсорбентами. Она связана с переходом вещества из газовой, паровой или жидкой фаз в твердую. Экстракция – извлечение растворенного в одной жидкости вещества другой жидкостью. Она связана с переходом вещества из одной жидкой фазы в другую. Кристаллизация (растворение) – выделение твердой фазы в виде кристаллов из растворов или расплавов. Она связана с переходом вещества из жидкой фазы в твердую (или наоборот). Общим для всех этих процессов является переход вещества из одной фазы в другую, то есть перенос массы в направлении достижения равновесия.
Таким образом, массопередачей называется процесс перехода вещества (или нескольких веществ) из одной фазы в другую в направлении достижения равновесия. Подобно теплопередаче, массопередача представляет собой сложный процесс, включающий перенос массы в пределах одной фазы, перенос через поверхность раздела фаз и перенос в пределах другой фазы. Аналогично тепловым процессам, перенос вещества из объема одной фазы к границе раздела с другой фазой или в обратном направлении называется массотдачей. Поскольку перенос вещества внутри фазы происходит путем диффузии, процессы массопередачи называются также диффузионными процессами. В большинстве процессов массопередачи участвуют три вещества и две фазы, которые являются носителями распределяемого вещества: 1) распределяющее вещество, составляющее первую фазу; 2) распределяющее вещество, составляющее вторую фазу; 3) распределяемое вещество, переходящее из одной фазы в другую. Массообменные процессы, как правило, обратимы, то есть переход распределяемого вещества может совершаться в любом направлении при отсутствии равновесия между фазами. Пусть вещество «М» находится только в газовой фазе «G» и имеет концентрацию У. В жидкой фазе «L» концентрацию Х = 0. Если распределяющие фазы привести в соприкосновение, то распределяемое вещество «М» начнет переходить из фазы «G» в фазу «L». При этом, естественно У уменьшается, а Х возрастает. С момента появления вещества «М» в фазе «L» начнется неизбежно и обратный переход распределяемого вещества. Скорость обратного перехода будет увеличиваться по мере возрастания концентрации Х и через определенный промежуток времени прямая и обратная скорости выравниваются. Устанавливается динамическое равновесное состояние, когда нет явного переноса массы из одной фазы в другую. Концентрации распределяемого вещества в этом состоянии называются равновесными (предельными): У* и Х*. Очевидно, что любой неравновесной концентрации Х соответствует равновесная концентрация У*, и наоборот: У* = f (X); X * = f (У). Равновесие между фазами часто представляют графически на У – Х –диаграмме. где У и Х – (относительные концентрации (кг распределяемого вещества/кг носителя).
Конкретные уравнения условий равновесия будут рассмотрены при описании отдельных процессов.
1. Чтобы определить скорость процесса в данных условиях и предусмотреть такие условия, чтобы процесс проходил с достаточной скоростью. Пусть в равновесии m частиц распределяемого вещества переходит из фазы «G» в фазу «L» и столько же обратно. Увеличим количество частиц распределяемого вещества на величину «n» в фазе «G». Скорость перемещения частиц в фазу «L» будет определяться не общим числом частиц m + n, а лишь избыточным «n» по отношению к равновесному. Скорость перехода распределяемого вещества из одной фазы в другую пропорциональна разности между фактической концентрацией эго вещества в данной фазе и равновесной концентрацией в ней же. Переход вызван этой разностью а, следовательно, она является движущей силой процесса. Материальный баланс массообменных процессов на примере абсорбции
Рассмотрим схему аппарата: G – количество распределяющей газовой фазы G в кг/час; L – количество распределяющей жидкой фазы L в кг/час;
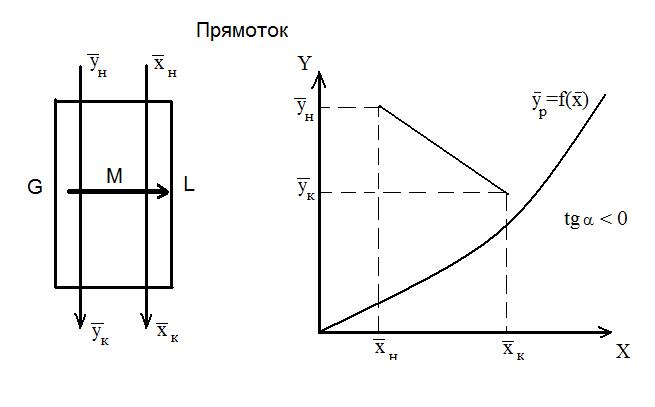
При Для условий противотока фаз имеем:
Это баланс по веществу в дифференциальной форме. Интегрируя в пределах от
Соотношение между количествами носителя в фазах: ℓ = Интегрирование уравнения (1) до текущих концентраций (баланс для нижней части аппарата)
Откуда
уравнение рабочей линии для низа колонны
Аналогично для верхней части аппарата:
уравнение рабочей линии для верха колонны (6)
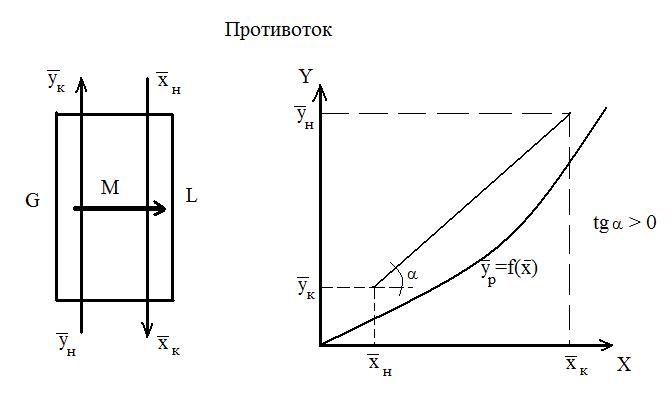
В случае прямотока фаз носителей это уравнение имеет следующий вид:
Эти уравнения (5-7), называемые уравнениями рабочей линии, выражают зависимость между составами контактирующих неравновесных фаз в любом сечении аппарата при рабочих условиях. Рабочая линия для всего аппарата ограничена точками с координатами Рабочая линия в координатах При абсорбции рабочая линия располагается выше равновесной, так как всегда Направление массопередачи можно определить по взаимному положению линий равновесия т рабочей линии (на У – Х – диаграмме). Распределяемое вещество всегда переходит из фазы, где его концентрация выше равновесной в фазе с концентрацией, ниже равновесной.
Положение рабочей линии при прямотоке и противотоке различно:
|
|||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 134; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.108.166 (0.012 с.) |

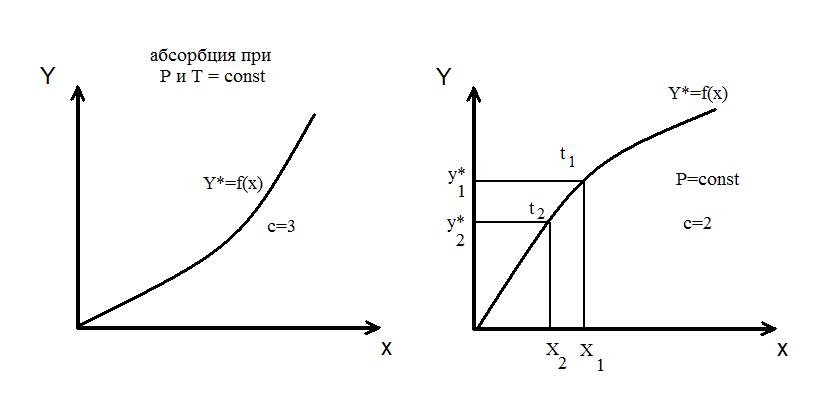 Кривая называется линией равновесия. В частном случае она может быть и прямой.
Кривая называется линией равновесия. В частном случае она может быть и прямой.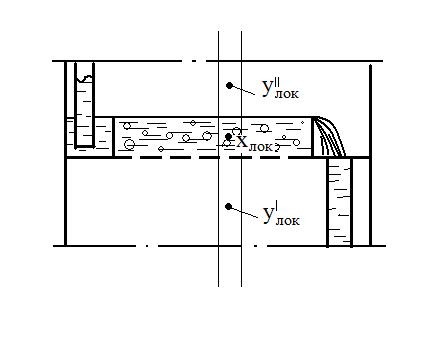
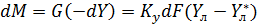
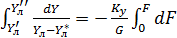
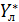 =const (
=const (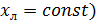 [для элемента dF]
[для элемента dF]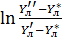 = -
= - 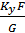
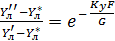
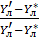 -
- 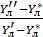 = 1-
= 1- 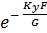
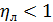
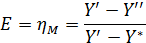
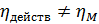
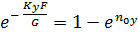
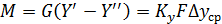
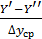 =
= 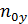 – число единиц переноса, приходящихся на 1 тарелку (определяется по специальным формулам).
– число единиц переноса, приходящихся на 1 тарелку (определяется по специальным формулам).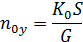
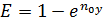
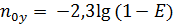
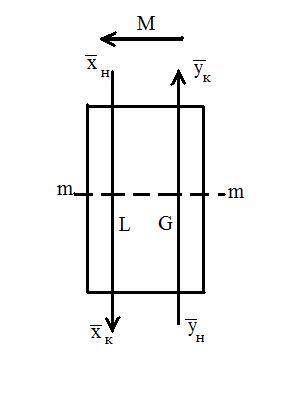
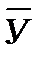 - концентрация распределяемого вещества М в фазе G, (кг вещества/кг носителя):
- концентрация распределяемого вещества М в фазе G, (кг вещества/кг носителя):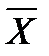 - концентрация распределяемого вещества М в фазе L, (кг вещества/кг носителя);
- концентрация распределяемого вещества М в фазе L, (кг вещества/кг носителя);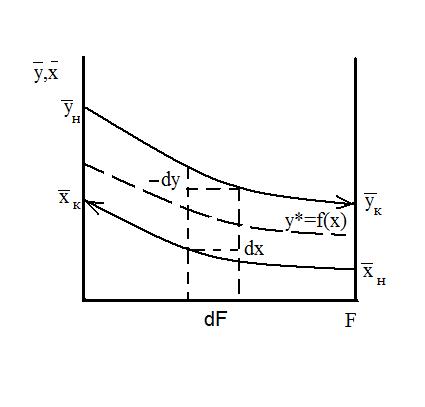
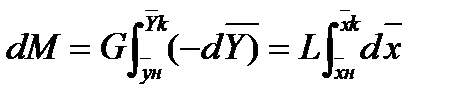 (1)
(1)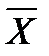 н
н 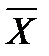 к
к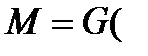
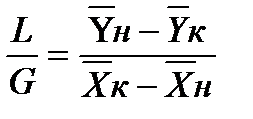 ; (3)
; (3)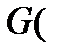
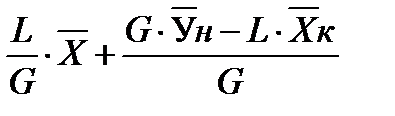 ; (5)
; (5)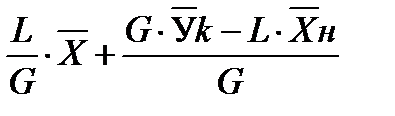 ;
; 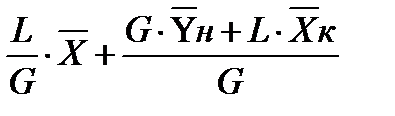 ; (7)
; (7)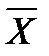 н
н 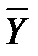 н
н 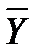 к
к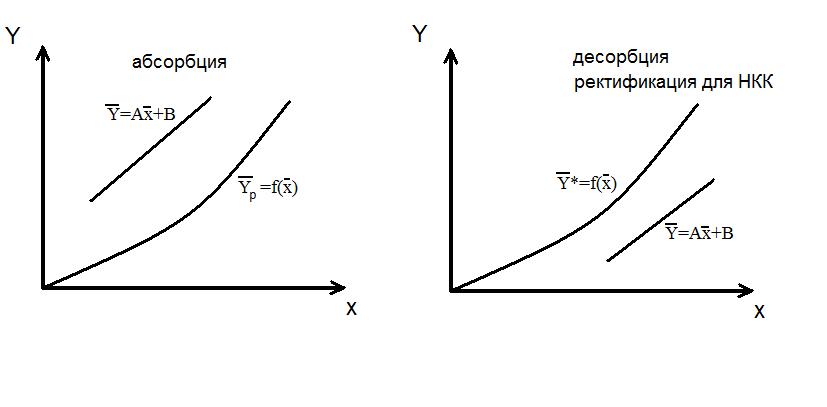 Десорбция → например, переход из жидкой в паровую фазу
Десорбция → например, переход из жидкой в паровую фазу