
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Качественные реакции на ионы железаСодержание книги
Поиск на нашем сайте В методических материалах по ЕГЭ рассматриваются следующие реакции: а) ионы железа(III) в щелочной среде образуют бурый осадок гидроксида: Fe+3 + 3OH– = Fe(OH)3¯
т.о. Fe+3 ионы можно обнаружить, добавив раствор щелочи или раствор соли, гидролизующейся по аниону; б) ионы железа(III) и роданид-ионы SCN– образуют комплексную соль винно-красного цвета, упрощенно: FeCl3 + 3NН4SCN = Fe(SCN)3 + 3NН4Cl
в) наиболее известная аналитическая реакция и ионов Fe+3 и Fe+2 – образование ярко-синего комплексного соединения KFe3+[Fe+2(CN)6], известного под названиями берлинская лазурь или турнбулева синь. Это соединение образуется, если к раствору соли железа(II) добавить гексацианоферрат(III) калия K3[Fe(CN)6] (т.н. красная кровяная соль), например: FeSO4 + K3[Fe(CN)6] = KFe3+[Fe+2(CN)6]¯ + K2SO4
Оно же образуется, если к раствору соли железа(III) добавить гексацианоферрат(II) калия (т.н. желтая кровяная соль), например:
FeCl3 + K4[Fe(CN)6] = KFe3+[Fe+2(CN)6]¯ +3KCl
Применение железа и его соединений Железо является основным компонентом сталей и чугунов – важнейших конструкционных материалов. Оксиды железа используются как пигменты, как катализаторы в химической промышленности. Хлорид железа(III) (т.н. хлорное железо) в растворе способно окислять малоактивные металлы медь и ртуть, его используют для травления печатных плат и для удаления металлической ртути.
Медь
Медь переходный металл золотисто-красного цвета, обладает высокой тепло- и электропроводностью, пластична. Медь относится к благородным металлам (в ряду активности расположена после водорода). В природе встречается самородная медь, важнейшими минералами меди являются халькопирит CuFeS2 (медный колчедан), медный купорос CuSO4×5H2O, малахит (CuOH)2CO3.
Получение меди Из-за малой активности, медь достаточно легко восстановить из соединений. C давних пор использовалась прямая выплавка из малахита:
(CuOH)2CO3 + 2СО = 2Cu + 3СО2 + Н2O
В настоящее время медь получают, преимущественно, из халькопирита CuFeS2, причем восстановителем является сама сульфидная сера. В лаборатории медь можно легко получить из оксидов – темно-красного Cu2O или черного CuO, эти реакции часто встречаются в заданиях повышенной сложности: CuO + H2
Cu2O + СО
3CuO + 2NH3
CuO + С
Химические свойства меди В соединениях медь проявляет две степени окисления: +1 и +2. Медь слабый восстановитель, окислить ее можно только сильными окислителями. 1. Из простых веществ медь реагирует только с кислородом, галогенами, серой: Cu + O2 (избыток)
Cu + O2 (недостаток)
Cu + Cl2 = CuCl2
Cu + S
2. Медь растворяется в азотной и концентрированной серной кислоте:
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO + 4Н2O
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 + 2Н2O
Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2Н2O
3. Медь не растворяется в воде, в кислотах-неокислителях, но в присутствии кислорода идут реакции:
2Cu + 4HCl + O2 = 2CuCl2 + 2Н2O
2Cu + СО2 + Н2O + O2 = (CuOH)2CO3
4. Медь – d -элемент, сильный комплексообразователь. Ион Cu2+ в водном растворе существует в виде иона тетрааквамеди [Cu(Н2O)4]2+ голубого цвета, без воды ион меди бесцветный. В присутствии аммиака образуется более стойкий аммиачный комплекс [Cu(NН3)4]2+ ярко-синего цвета, например: [Cu(Н2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ + 4Н2O
или в молекулярном виде (молекулы воды обычно не указывают):
CuSO4 + 4NH3 = [Cu(NH3)4]SO4 голубой ярко-синий
Аммиачный комплекс меди образуется при растворении гидроксида меди(II) и даже оксида меди(II) в растворе аммиака:
Cu(OH)2¯ + 4NH3×Н2O = [Cu(NH3)4](OH)2 + 4Н2O
CuO + 4NH3×Н2O = [Cu(NH3)4](OH)2 + 3Н2O
5. Как и железо, медь имеет две степени окисления, поэтому возможны реакции: Cu0 + Cu+2O
Cu0 + Cu+2Cl2 + 2NaCl = 2Na[Cu+1Cl2]
Последняя реакция протекает, так как образуется устойчивый комплексный ион.
|
||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 129; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

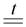 Cu + H2O
Cu + H2O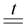 CuO
CuO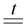 Cu2O
Cu2O


