Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
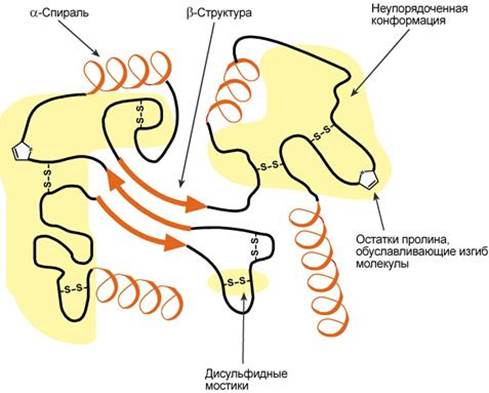
Понятие о надвторичной структуре белка. Структурные и функциональные домены. Причины формирования третичной структуры белковой молекулы.
Надвторичные структуры — это особые участки в белковых молекулах, которые отличаются структурной и функциональной специфичностью. Иначе их называют домены или доменные области (от лат. dominium - владение, вотчина). Как правило, они возникают при взаимодействии радикалов аминокислот между собой. При этом наблюдается особая поляризация или, наоборот, гидрофобный участок, куда будут адсорбироваться ионы металлов, какого-либо органического соединения или другого белка. В зависимости от дальнейших превращений доменные области проявляют каталитические, структурообразующие или иные функции. --- Третичная структура белка. Силы, стабилизирующие третичную структуру. Конформационные изменения при функционировании белков. Денатурация белка и факторы, ее вызывающие. Использование явления денатурации в медицинской практике. Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, однако в основе третичной структуры лежат стерические взаимосвязи между аминокислотами, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи.
Аминокислоты принимают участие в формировании третичной структуры, образуя связи своими функциональными группами (радикалами), например: - водородные – между НО-, СООН-, NH2-группами радикалов аминокислот, - дисульфидные – между остатками цистеина, - гидрофобные – между остатками алифатических и ароматических аминокислот, - ионные – между СОО–-группами глутамата и аспартата и NH3+-группами лизина и аргинина, - псевдопептидные – между дополнительными СОО–-группами глутамата и аспартата и дополнительными NH3+-группами лизина и аргинина.
Гидрофобные взаимодействия, а также ионные и водородные связи относят к числу слабых, так как их энергия лишь ненамного превышает энергию теплового движения атомов при комнатной температуре (т.е. уже при данной температуре возможен разрыв таких связей). Поддержание характерной для белка конфор-мации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи. Однако белки состоят из огромного числа атомов, находящихся в постоянном (броуновском) движении, что приводит к небольшим перемещениям отдельных участков полипептидной цепи, которые обычно не нарушают общую структуру белка и его функции. Следовательно, белки обладают конформационной лабильностью - склонностью к небольшим изменениям конформации за счёт разрыва одних и образования других слабых связей. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом.
Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции. 1. Физическая денатурация Вызывается повышением температуры, ультрафиолетовым и микроволновым излучением, механическими воздействиями, ионизацией заряженными частицами. 2. Химическая денатурация Зависит от природы денатурирующего реагента: - кислоты и щелочи образуют водородные связи с пептидными группами, - органические растворители образуют водородные связи и вызывают дегидратацию, - алкалоиды образуют связи с полярными группами и разрывают систему водородных и ионных связей, - тяжелые металлы взаимодействуют с заряженными радикалами, нейтрализуют отрицательные заряды и разрывают систему водородных и ионных связей. --- 9. Четвертичная структура белков. Преимущества существования белков с четвертичной структурой. Кооперативные изменения конформации полипептидных цепей при функционировании белков с четвертичной структурой на примере гемоглобина. Сравнительные особенности транспорта кислорода гемоглобином и миоглобином. Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой. Например, гемоглобин – белок эритроцитов, переносящий кислород, состоит из 4 гемсодержащих субъединиц – 2 α-субъединицы и 2 β-субъединицы в гемоглобине взрослых, 2 α-субъединицы и 2 γ-субъединицы в фетальном гемоглобине.
Лактатдегидрогеназа – фермент, принимающий активное участие в окислении глюкозы в бескислородных условиях, также включает 4 субъединицы – Н (heart) и М (muscle) в разных сочетаниях: Н4, Н3М1, Н2М2, Н1М3, М4. Всего 5 изоферментов. Креатинкиназа – фермент, участвующий в регенерации АТФ при мышечном сокращении, состоит из 2 субъединиц – В (brain) и М (muscle) в разных сочетаниях: ВВ, ВМ, ММ. Всего 3 изофермента. Взаимодействие протомеров друг с другом осуществляется по принципу комплементарности, т.е. их поверхность подходит друг другу по геометрической форме и по функциональным группам аминокислот (возникновение ионных и водородных связей). Так как субъединицы в олигомерах очень тесно взаимодействуют между собой, то любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется кооперативное взаимодействие. Например, в легких у гемоглобина кооперативное взаимодействие субъединиц в 300 раз ускоряет присоединение кислорода к гемоглобину. В тканях отдача кислорода также ускоряется в 300 раз.
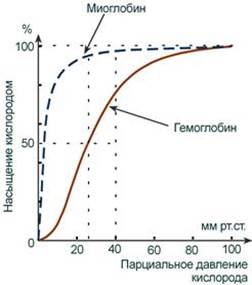
Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следующую субъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и так далее. Миоглобин является одиночной полипептидной цепью, состоит из 153 аминокислот с молекулярной массой 17 кДа и по структуре сходен с β-цепью гемоглобина. Белок локализован в мышечной ткани. Миоглобин обладает более высоким сродством к кислороду по сравнению с гемоглобином. Это свойство обусловливает функцию миоглобина – депонирование кислорода в мышечной клетке и использование его только при значительном уменьшении парциального давления О2 в мышце (до 1-2 мм рт.ст).
Кривые насыщения кислородом показывают отличия миоглобина и гемоглобина: - одно и то же 50%-е насыщение достигается при совершенно разных концентрациях кислорода – около 26 мм рт.ст. для гемоглобина и 5 мм рт.ст. для миоглобина, - при физиологическом парциальном давлении кислорода от 26 до 40 мм рт.ст. (в тканях) гемоглобин насыщен на 50-80%, тогда как миоглобин – почти на 100%. Таким образом, миоглобин остается оксигенированным до того момента, пока количество кислорода в клетке не снизится до предельно малых величин. Только после этого начинается отдача кислорода для реакций метаболизма. ---
|
||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 322; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.242.141 (0.01 с.) |