
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Математическая характеристика обратимых процессов. Принцип сохранения антропии в замкнутой системе при обратимых процессах.Содержание книги
Поиск на нашем сайте
Итак, мы с вами установили математические характеристики 3-х видов обратимых машин Карно:
обратимого двигателя (3.4.): htk=1- обратимой холодильной машины (3.6.): EK= обратимого теплового насоса (3.7.): yк=
Давайте попробуем для этих же машин установить более общую математическую характеристику, которую мы могли бы распространить на весь класс обратимых тепловых машин, а не только на машины Карно. Для конкретности возьмем обратимый тепловой двигатель, для которого, как мы уже знаем термический КПД цикла может быть определен через отношения теплот или температур: ht= 1-
следовательно мы можем записать:
Окончательно получим, что алгебраическая сумма приведенных теплот цикла Карно будет равно “0”: тепло подводится (+) тепло отводитя (-)
Полученная нами математическая характеристика цикла Карно, может быть распространена и на другие типы обратимых тепловых двигателей. Пусть мы имеем произвольный обратимый тепловой двигатель, работающий по циклу 1-а- 2- в-1.
Данный цикл будет обратимым, при условии наличия в нем ¥ большого числа теплоотдатчиков и теплоприемников (реализация допущения от ¥ Ср).
Спомощью адиабат разобьем этот цикл на бесконечно большое число элементарных циклов.
В каждом таком элементарном цикле будет осуществляться подвод элементарного количества теплоты dq1 при практически постоянной температуре Т1 и отводится элементарное количество теплоты dq2 при практически Const температуре Т2. Т.е. каждый такой элементарный цикл представляет собой цикл Карно, для которого, в соответствии с нашими предыдущими рассуждениями справедливо: q2(-)т.к. отводится).
Просуммировов отводы и подводы теплоты по всем элементарным циклам, то получим, что:
j
Полученное нами выражение (3.9.) носит название интеграл Клаузиуса и является общей математической характеристикой обратимых циклов с любым рабочим телом. Она формируется как:
Сумма приведенных теплот по замкнутому контуру обратимого цикла равна “0”. В интеграле Клаузиуса, под знаком интеграла находится отношение dq/Т, которое мы с вами, несколько раньше уже рассматривали, и доказали, что
Соответственно величину S[кДж/кг к] мы назвали энтропией и рассматривали ее как особое свойство идеального газа, являющееся функцией его состояния и соответственно параметром состояния. Выражение
S2-S1=
(р.s. Принцип существования энтропии говорит, что dq/Т, будучи полным дифференциалом, измеряет собой изменения некоторой величины, названной Клаузиусом энтропией, являющейся по своей природе функцией состояния).
Таким образом, в соответствии с полученной математической характеристикой любых обратимых циклов (уравнение 3.9.)мы можем сформулировать принцип постоянства энтропии системы при замкнутых ¥ (циклах) обратимых процессах: jdS = 0 (3.10.) dS=0 => S2=S1=Const В обратимых циклах энтропия системы остается без изменения. Энтропия отдельных тел системы может изменяться, в то время как энтропия всей системы в целом остается постоянной. Данный факт можно проиллюстрировать на примере обратимого двигателя Карно.
Итак, имеем систему, состоящую из теплоотдатчика “А” с температурой Т1; теплоприемника “В” с температурой Т2 и рабочего тела, совершающего цикл Карно.
Т.к. рабочее тело совершает обратимый цикл Карно, то для него, в соответствии с принципом постоянства энтропии системы при замкнутых обратимых процессах изменение энтропии равно 0. DSрт =0.
Теплоотдатчик “А” отдает тепло рабочему телу, и изменение его энтропии будет равно: DSA =
Теплоприемник “В” принимает тепло, и изменения его энтропии равно: D
т.к. (см. стр.90)
Полное изменение энтропии системы определится как: DS=DSpT+DSA+DSB=0.
Таким образом принцип постоянства энтропии является выражением второго закона термодинамики применительно к замкнутым обратимым процессам.
Прежде, чем перейти к рассмотрению необратимых процессов давайте немного поговорим об работоспособности термодинамических систем.
3.5. Энергия термодинамической системы. Уравнение энергетического баланса при обратимых процессах.
Давая базисные формулировки 2-го закона термодинамики, в одной из них, а именно в формулировке Карно мы установили, что не вся теплота, тобишь термическая энергия, может перейти в тепловой машине в работу. Часть ее обязательно должна быть передана теплоприемнику.
В соответствии с этим постулатом, трактовка понятия “энергии”, как “способности системы производить работу” является полностью справедливой лишь для некоторых ее видов, например, механической и электрической. Для термической же энергии, энергии энтропийного типа, способность превращения ее в работу ограничена 2-ым законом термодинамики (вокруг нас, воздух, содержит огромное количество тепловой энергии, но она не может превратиться в работу, нет вечного двигателя 2-го рода).
Поэтому, для характеристики термической работоспособности термодинамической системы ввидится понятие энергии. Энергия - это способность термодинамической системы производить “рабрту”, в условиях о пределенного состояния окружающей среды (полезная работа ГТУ при -30°С на улице болдьше, чем при +30°С).
Eх [кДж] ех [кДж/кг].
В соответствии с данным нами определением понятие энергии, в строгом смысле относится к совокупности: термодинамическая система + окружающая среда (ТДС+ОС). Однако, при строго определенном состоянии окружающей среды, энергия термодинамической системы является функцией состояния этой системы.
Численно величина энергии Ех равна максимальной работе обратимого процесса, которую может выполнить рабочее тело при переходе из состояния а (Ра, tа) в состояние равновесия с окружающей средой О(Ро, Vо).
Давайте попробуем получить уравнение для определения энергии термодинамической системы. Для этого, будем считать, что переход системы от данного состояния к состоянию равновесия происходит при следующих допущениях:
а) процесс во всех своих частях является строго обратимым;
б) отвод неиспользованной теполты осуществляется лишб при температуре окружающей Среды (изотермически). Т.к. во всех непрерывно действующих тепловых машинах рабочее тело находится в условиях непрерывного потока, то энергию системы мы будем оценивать понятием энтальпия i, и работу обратимого процесса — располагаемой — Рассмотрим процесс расширения 1 кб газа от Ра; Та, до состояния равновесия с окружающей средой. Процесс изобразим в Р-V и Т-S диаграмме, при этом разобьем его на 2 участка: сначала расширение (адиабатическое от Ра; Та до Рс; То; затем изотермическое расшиерние до Ро; То.
Для этих двух участков определим располагаемые работы расширения:
1) S=Const: l1 1=Di=ia-i0=ia-i0 q=0 т.к. для обратимых процессов i однозначно определяется Т.(т.к. в адиабатическом процессе q=0 и l=Di, а в изотермическом процессе Di=0=>ic=i0)
2) T0= Const: l 12=T0(S0-Sa) q=l для изотермического процесса (т.к. в изотермическом процессе Di=0=>q=l1 и кроме того мы знаем, что DS=q/То => q=To(So-Sa)=l1 (для изотермического процесса)).
Сумма работ lXa=(ia-i0)+T0(S0-Sa) (3.11.)
где ia и Sa - энтальпия и энтропия рабочего тела в исходном состоянии. i0 и S0 - энтальпия и энтропия рабочего тела в состоянии равновесия с окружающей средой.
Из полученного уравнения (3.11.)мы видим, что величина энергии зависит не только от энергии т.д.с. в данном состоянии ia, но и от энтропии Sa., т.е. энергия т.д.с. рассматривается как сумма 2-х компонентов энтальпийного (ia-i0) и энтропийного (Sa-Sa).
Физический смысл энтальпийного компонента(ia-i0) в том, что он показывает убыль количества энергии системы при переходе из состояния “а” в состояние “0”.
Давайте попробуем проанализировать энтропийный компонент То(Sо-Sa), который тем больше, чем меньше энтропия исходного состояния рабочего тела.
Меньшая энтропия S соответствует большей упорядоченности структуры веществаю.(энтропия пара больше, чем жидкости).
Исходя из сказанного существует 2 противоположных случая:
1. Sa<S0®T0(S0-Sa)>0 (вода®пар). При переходе системы от начального состояния к состоянию равновесия с окружающей средой высвобождается часть энергии обусловленная более прочной упаковкой системы (испарения). В условиях обратимости высвобождаемый энтропийный компонент служит средством для выполнения работы. Энергия системы возрастает.(паровая турбина и водяная). 2. Sa>S0®T0(S0-Sa)<0 (пар ®конденсат, горячий газ®холодный газ после расширения). В этом случае происходит “упаковка вещества”, на которую необходимо потратить часть энтальпийного компонента. Энергия системы падает.
Таким образом мы можем сделать вывод, что термическая(энтропийная) энергия является “ограниченно пригодной” для превращения в другие виды энергии (в частности в механическую работу). Кроме того понятие энергии дает возможность качественной оценки термической энергии.
Теперь, разобравшись с понятием энергии термодинамической системы давайте критически посмотрим на выражение 1-го закона термодинамики для открытой т.д.с.: q=(i2-i1)+l1=>l1=q-(i2-i1) l1= (i1-i2)+q
Недостатком этого уравнения, в в соответствии со 2-ым законом термодинамики, является качественная неравноценность входящих в него видов энергии q и l. Это обусловлено разной пригодностью данных видов энергии для совершения работы процесса.
Поэтому, для избежания ошибочных заключений при оценке термодинамических превращений теплоты в работу, наряду с уравнением теплового баланса приходится пользоваться и уравнением энергобаланса, которое мы с вами сейчас и получим.
Пусть в условиях обратимого термодинамического процесса 1-2, рабочему телу из вне сообщается теплота q. При этом работоспособность этой теплоты (max) в соответствии с учением Карно составит:
lXq=ht l1lXq®DlX
Сообщаемая система работоспособности (дополнительная за счет теплоты) должна пойти частично на совершение системой работы l, а частью на изменение работоспособности системы при переходе из состояния 1 в состояние 2: DlX=lX2-lX1. Т.е. мы можем записать, что: lXq=DlX+l1= (lX2-lX1)+l1
из данного уравнения мы можем выразить располагаемую работу поцесса как: l1=lXq+(lX1-lX2) (3.12.)
Данное уравнение 3.12. называется уравнением энергетического баланса для обратимых термодинамических процессов. Оно гласит, что: При обратимых термодинамических процессах располагаемая техническая работа l создается за счет перепада энергии системы и за счет работоспособности подводимой теплоты lXq.
Необходимость применения уравнения энергобаланса при исследовании термодинамических процессов можно показать на примере решения простейшей задачи.
Пусть 1кб сжатого воздуха при давлении Ра=5 бар и темературе tа=17°С и равной температуре окружающей Среды, проходя через детандер притерпевает изотермическое расширение до давления окружающей Среды равной р0=1 бар.
В данных условиях в соответствии с 1-ым законом термодинамики:
l 1из=RT (однако,заметьте, что это работа располагаемая, как бы та, которую можно совершить).
Изменение энтальпии воздуха для изотермического процесса, равное Di=CрDТ=0=> в соответствии с 1-ым законом термодинамики и его мат. выражением энергобаланса имеем, что q=Di+l1=l1=133,7 кДж
Получается, что в данном примере теплота, получаемая от окружающей Среды полностью превращается в работу. Однако, в соответствии со вторым законом термодинамики, теплота, полученная из окружающей Среды, неработоспособна. Невозможно создать вечный двигатель второго рода.
Это видно из уравнения энергобаланса: и работа может совершаться только за счет изменения имеющейся энергии системы DlX=lX1-lX2
До сих пор мы с вами имели дело только с обратимыми термодинамическими процессами, которых в природе и технике не существует. Теперь давайте спустимся на грешную землю и поговорим о реальных, необратимых термодинамических процессах. Подзаголовок.
|
||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 113; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.5 (0.011 с.) |




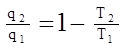
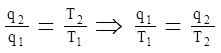
 - называется приведенная теплота.
- называется приведенная теплота.
 (3.8.)
(3.8.) (теплота q1(+) т.к. подводится,
(теплота q1(+) т.к. подводится, ;
; (3.9.)
(3.9.) dS - изменение энтропии рабочего тела в обратимом процессе.
dS - изменение энтропии рабочего тела в обратимом процессе. является математическим выражением второго закона термодинамики для обратимых процессов и представляет собой принцип существования энтропии. Для конечного процесса, протекающего от состояния 1 до состояния 2 он принимает вид:
является математическим выражением второго закона термодинамики для обратимых процессов и представляет собой принцип существования энтропии. Для конечного процесса, протекающего от состояния 1 до состояния 2 он принимает вид: [кДж/кг к]
[кДж/кг к]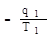 (“-” показывает, что теплоотдатчик тепло отдает)
(“-” показывает, что теплоотдатчик тепло отдает)

 .
. и позволит нам определить энергию 1 кг рабочего тела (идеального газа) для сост. “А”
и позволит нам определить энергию 1 кг рабочего тела (идеального газа) для сост. “А” =((T-T0)/Т)´q (см. max возможную работу цикла Карно l0max на стр.84) (3.5.)
=((T-T0)/Т)´q (см. max возможную работу цикла Карно l0max на стр.84) (3.5.) = 287´290 ln 5= 133,7 кДж/кб
= 287´290 ln 5= 133,7 кДж/кб



