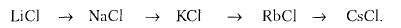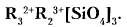Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Какие симметрические операции задает пространственная решетка?Стр 1 из 5Следующая ⇒
Какие симметрические операции задает пространственная решетка? Пространственная решетка задает и осуществляет повторяемость эквивалентных точек кристаллического пространства. Она размножает точки пространства присущими решетке трансляциями. Объясните термин "тип решетки Браве". Какие типы решеток вы знаете? Приведите примеры структур с различными типами решеток Браве. Тип решетки Браве - это определенный вид ячейки, обладающей симметрией структуры и имеющей минимальный объем из всех ячеек такого же качества. Типы решеток Браве: примитивная P, базоцентрированная C, бокоцентрированная A, B, объемноцентрированная I, гранецентрированная F, дважды объемноцентрированная R. Примеры: P (хлористый цезий, вюрцит, никелин), F (алмаз, галит, медь), I (железо), R (бета-графит, CdI2) Что называется элементарной ячейкой? Принципы ее выбора. Элементарная ячейка - это минимальный воображаемый объем кристалла, трансляции которого позволяют построить трехмерную кристаллическую решетку в целом. Элементарную ячейку нужно выбирать так, чтобы она была наименьшей, но отражала симметрию, присущую структуре, в целом. Что называется пространственной решеткой и чем она отличается от кристаллической структуры? Пространственная решетка - это своеобразный элемент симметрии, задающий и осуществляющий повторяемость эквивалентных точек кристаллического пространства в трех некомпланарных направлениях. Пространственная решетка - это геометрическая схема кристаллической структуры, в которой остаются геометрические параметры трансляций, но не указывается конкретное размещение атомов в данной структуре. Что такое координационные числа и координационные многогранники? Примеры. Координационное число - это число ближайших к данному атому (иону) соседних атомов (ионов) в структуре кристалла. Например, в структуре CsCl координационные числа всех атомов равны 8. Координационный многогранник - это многогранник, в вершинах которого располагаются лиганды. Например, в структуре флюорита КМ вокруг иона кальция имеет форму куба. Что такое число формульных единиц? Его подсчет. Что необходимо знать, чтобы определить это число? Примеры. Число формульных единиц - это число атомов в элементарной ячейке для простых веществ, молекул - для простых молекулярных веществ, для подавляющего большинства неорганических и интерметаллических соединений, в которых нет молекул, этот термин используют вместо термина "количество молекул". Для его определения нужно подсчитать число атомов каждого сорта, приходящихся на одну элементарную ячейку.
Например, в структуре флюорита на одну элементарную ячейку приходится 4 атома кальция и 8 атомов фтора, составляющие 4 формульных единицы "CaF2". Типы химической связи. Природа ковалентной связи. Примеры структур. Типы химической связи: металлическая (медь), ионная (галит), ковалентная (алмаз), ван-дер-ваальсова (Cl2), водородная (CO2). При ковалентной связи электронная пара становится общей для связываемых атомов и притягивает их ядра при взаимном объемном перекрывании атомных орбиталей этих атомов. Координационные числа и многогранники, реализуемые в структурах с преимущественно ковалентной связью. Т.к. число электронов, осуществляющих ковалентные связи, у каждого атома ограниченно, то для структур с этим типом связи характерны малые координационные числа (обычно не больше 4). Основной координационный многогранник - тетраэдр. Что такое металлическая связь? Каковы ее особенности? Ее реализация в кристаллических структурах. Примеры. Металлическая связь - это химическая связь, осуществляемая взаимодействием свободных электронов и положительно заряженных атомных ядер. Металлический кристалл можно представить как решетку из положительно заряженных атомных ядер, погруженных в отрицательно заряженный "газ" из свободных электронов. Модели структур с металлической связью строятся из атомов одинакового или близкого размера, уложенных наиболее компактно. Поэтому для металлических структур характерны большие КЧ, плотнейшие упаковки частиц. Примеры: медь, магний. Особенности ионной связи и ее реализация в кристаллический структурах. Примеры структур с этим типом связи. В ионных кристаллах нет молекул, т.е. нет границ между структурными единицами. И т.к. электрический заряд распределяется по всей поверхности иона, то катионы стремятся окружить себя большим числом анионов так, что кулоновское отталкивание компенсируется взаимным кулоновским притяжением. Поэтому для таких структур характерны достаточно высокие КЧ (6,8), нередко встречаются плотнейшие упаковки атомов. Примеры: NaCl, KI, KF.
Особенности ван-дер-ваальсовой связи и ее реализация в кристаллических структурах. Примеры структур с этим типом связи. Ван-дер-ваальсовы связи на полтора порядка слабее ковалентных и ионных. Они быстро ослабевают с увеличением межатомных расстояний, но всегда присутствуют в качестве добавочных в кристалле любого типа. Структуры с этим типом связи часто подчиняются законам плотнейших упаковок, поэтому КЧ характеризуются большими величинами. Примеры: Cl2, Ar, Kr.
В чем суть полиэдрического метода изображения кристаллических структур? Примеры. В этом методе шары, образующие плотнейшую упаковку, всегда соответствуют анионам. Если соединить между собой центры тяжести этих шаров, все пространство разбивается на октаэдры и тетраэдры. Модель составляется только из полиэдров - пустот, заполненных катионами. Таким образом от шара остается только его центр - вершина полиэдра, катион находится в центре этого полиэдра. Т.к. взаимное расположение октаэдрических и тетраэдрических пустот позволяет определить тип плотнейшей упаковки, то указание ее слойности и описанием геометрии заполнения пустот позволяет составить представление об атомной структуре кристалла. Какие структуры относят к гомодесмическим? Каков их геометрический характер? Примеры. Если в кристалле тип химической связь между всеми атомами одинаков, то такие структуры называют гомодесмическими. Атомы равномерно распределены по всему кристаллическому пространству, при этом они не образуют каких-либо конечных или бесконечных группировок (молекул). Такие структуры характеризуются одинаковыми расстояниями между соседними атомами. Примеры: NaCl (ионная связь), Cu (металлическая связь).
Какие структуры относят к гетеродесмическим? Каков их геометрический характер? Примеры. Если в кристалле реализуется несколько типов химической связи, то такие структуры называют гетеродесмическими. Их характерная черта — присутствие структурных фрагментов, внутри которых атомы соединены наиболее прочными (обычно ковалентными) связями. Эти фрагменты могут представлять собой конечные группировки атомов, цепи, слои, каркасы. Соответственно выделяются островные, цепочечные, слоистые и каркасные структуры. Примеры: в островной структуре хлора связь между двумя атомами Cl в молекуле ковалентная, тогда как между атомами Cl из разных молекул осуществляется ван-дер-ваальсова связь. В слоистой структуре а-графита ковалентпые (с примесью металлической) связи реализованы внутри слоя и ван-дер-ваальсовы — между слоями.
В чем суть явления полиморфизма? Примеры. Полиморфизм - это явление существования химического соединения в двух или нескольких модификациях, различающихся между собой кристаллическими структурами. Это реакция кристаллического вещества на изменение физико-химических условий. Например, известны две полиморфные модификации серы: ромбическая и моноклинная. Превращение одной модификации в другую про исходит при Т = 95,6° С. Структура CsCl, при обычной температуре относящаяся к кубической а-модификации (Р-решетка Браве), после нагревания до 7= 445° С переходит в модификацию со структурой типа NaCl. Переход обратим.
В чем суть явления изоморфизма? Примеры. Изоморфизм — это взаимное замещение химических элементов в кристаллических структурах, т. е. образование смешанных кристаллов, обусловленное близостью объемных структурных единиц и их химической природы. Пример: замещение Mg на Fe в оливине.
Что такое совершенный изоморфизм и чем он отличается от несовершенного? Приведите примеры. Если два вещества дают изоморфные смеси любых концентраций (непрерывный ряд твердых растворов), то изоморфизм называют совершенным. В противном случае говорят о несовершенном изоморфизме. Совершенный изоморфизм характерен только для изоструктурных веществ, имеющих сходное пространственное расположение атомов или ионов и поэтому сходные по внешней форме кристаллы. Для несовершенного изоморфизма условие изоструктурности необязательно. Пример совершенного изоморфизма - кристаллы квасцов KAl(SO4)*12H2O, в которых ионы К + могут в любом количестве замещаться ионами Rb+, (NH4)+. Пример несовершенного изоморфизма: кальцит и магнезит имеют одинаковые структуры, но непрерывных твердых растворов Са и Mg не образуют.
Чем отличается гетеровалентный изоморфизм от изовалентного? Примеры. Процесс замещения частиц одинаковой валентности носит название изовалентного изоморфизма, разновалентных — гетеровалентного. Наиболее легко реализуется изовалентный изоморфизм — замещение одних атомов другими происходит без изменения общего числа атомов в структуре. Например, в группе оливинов — фаялит Fe2[SiO4]и форстерит Mg2[SiO4] где 2Fe2+ замещаются на 2Mg2+. Пример гетеровалентного изоморфизма: в полевых шпатах — альбите NaAlSi3O8 и анортите CaAl2Si2O8, где замещение Na+ на Са2+ сопровождается заменой Si4+ на АL3+.
В чем суть явления морфотропии? Примеры. При закономерном изменении химического состава в некотором ряду сходных соединений в какой-то момент наблюдается резкое изменение формы кристаллов. Это явление называется морфотропией. В качестве примера рассмотрим соединения с типом химической формулы АХ — ряд хлоридов щелочных металлов В этом ряду первые четыре соединения относятся к структурному типу NaCl, переход к CsCl сопровождается резким изменением структурного типа: если первая группа характеризуется КЧ = 6 для катионов, то для CsCl КЧ(Cs)= 8
В чем суть явления политипии? Примеры. Политипия - такие полиморфные превращения, при которых неизменными сохраняются целые участки структур. В качестве примера можно рассмотреть различные модификации Cdl2. Валентно-насыщенные пакеты CdI2, — слои из CdI2-октаэдров — чередуются со слоями вакантных октаэдрических пустот в структурах, построенных по закону различных плотнейших упаковок. По нескольку десятков политипных модификаций описано для таких каркасных структур, как SiC и ZnS.
Что положено в основу классификации силикатов? Основные подразделения классификационной таблицы силикатов. Объединение тетраэдров через общие кислородные вершины приводит к большому числу разнообразных кремнекислородных мотивов, которые и были положены в основу классификации силикатов.
В чем отличие алюмосиликатов от силикатов алюминия? Примеры. Алюмосиликатами называются только такие силикаты, в которых алюминий окружен четырьмя атомами кислорода и даже изоморфно замещает кремний (т.е. роль глинозема действительно близка (но не идентична) роли кремнезема). В других случаях алюминий в силикатах окружен шестью атомами кислорода. Примеры: силикаты алюминия - гранаты, каолин, алюмосиликаты - полевые шпаты (альбит, ортоклаз, анортит).
В чем отличие ортосиликатов от диортосиликатов? Примеры структур с указанными Si-O-мотивами. Кремнекислородный мотив представлен в соединениях этой группы силикатов изолированными [SiO4]-ортотетраэдрами, т. е. тетраэдрами, не имеющими между собой общих — «мостиковых» — атомов кислорода. Примеры: оливин, топаз, циркон. Кремнекислородный мотив диортосиликатов [Si2O7], представленный изолированной группой из двух связанных через общую вершину («мостиковый» атом кислорода) кремнекислородных тетраэдров. Примеры: тортвейтит, каламин. С каким явлением связано разнообразие минералов группы гранатов? Назовите эти группы и приведите примеры.
Гранат — общая формула Кубическая структура граната устойчива в весьма широком диапазоне катионных замещений. Изоморфным замещениям подвержены как позиция двухвалентного катиона R2+, которая может быть занята Mg, Fe, Mn, Са, так и позиция трехвалентного катиона R3+ — Al, Fe, Сr. Группы гранатов: пиральспиты (пироп, альмандин, спессартин), уграндиты (уваровит, гроссуляр, андрадит).
Какие симметрические операции задает пространственная решетка? Пространственная решетка задает и осуществляет повторяемость эквивалентных точек кристаллического пространства. Она размножает точки пространства присущими решетке трансляциями. Объясните термин "тип решетки Браве". Какие типы решеток вы знаете? Приведите примеры структур с различными типами решеток Браве. Тип решетки Браве - это определенный вид ячейки, обладающей симметрией структуры и имеющей минимальный объем из всех ячеек такого же качества. Типы решеток Браве: примитивная P, базоцентрированная C, бокоцентрированная A, B, объемноцентрированная I, гранецентрированная F, дважды объемноцентрированная R. Примеры: P (хлористый цезий, вюрцит, никелин), F (алмаз, галит, медь), I (железо), R (бета-графит, CdI2)
|
||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 180; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.25.74 (0.029 с.) |