Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Описание к лабораторной работе 19 о
Нильс Бор в 1913 году создал первую неклассическую теорию атома. В основе этой теории лежала идея связать в единое целое три результата, полученные в физике к тому времени: а) эмпирические закономерности линейчатого спектра атома водорода, выраженные в формуле Бальмера-Ридберга (сериальная формула):
где ν − частота излучаемого света, λ − длина волны излучаемого света, с − скорость света, R − постоянная Ридберга, k и n − целые числа, причем n = k + 1, n = k + 2, n = k + 3,...; (k ≠ 0); б) ядерную модель атома Резерфорда, не допускающую классического толкования; в) квантовый характер излучения и поглощения света.
В основе теории Бора лежат три постулата:
I. Постулат стационарных орбит. Существуют некоторые стационарные состояния атома, находясь в которых он не излучает энергии. Этим стационарным состояниям соответствуют вполне определенные (стационарные) орбиты, по которым движется электрон в атоме.
II. Правило квантовых орбит. В стационарном состоянии атома электрон, двигаясь по круговой орбите должен иметь квантовые значения момента импульса L, удовлетворяющие условию:
где n = 1, 2, 3,..., m − масса электрона, v − скорость электрона, r − радиус его орбиты, h − постоянная Планка.
III. Правило частот. При переходе атома из одного стационарного состояния в другое испускается или поглощается один квант энергии, величина которого определяется формулой (4). Изменение энергии атома, связанное с излучением или поглощением электромагнитных волн, пропорционально частоте этих волн. Если ΔW − изменение энергии атома в результате этих процессов, то
ΔW = hν (3)
Формула (3) может быть записана иначе. Если Wn и Wk − энергии атома в двух стационарных состояниях, то
Wn − Wk = hν (4)
При Wk < Wn происходит излучение кванта, при Wk > Wn − его поглощение. выразив ν из формулы (4) и сопоставив со значением ν из формулы (1), получим выражение для энергии атома в некотором стационарном состоянии:
Знак «минус» указывает, что электрон связан в атоме силой притяжения к ядру.
Величина
называется спектральным термом. Излучение спектров показало, что частоты спектральных линий могут быть представлены в виде разностей двух термов:
ν = Tk − Tn (8)
Это можно видеть из сопоставления формул (1) и(5). Таким образом, термы эмпирических сериальных формул приобрели в теории Бора физический смысл, связанный с энергией стационарных состояний атома. А сам процесс излучения получил количественные объяснения как переход электрона из стационарного состояния n в стационарное состояние k. Целые числа n и k, определяющие энергетические уровни в формулах (1) и (5), называются главными квантовыми числами. Излучение кванта энергии атомом происходит, если электрон переходит с более высокого энергетического уровня на нижележащий, т. е. перед излучением атом должен быть возбужденным. Процессы возбуждения атомов заключаются в сообщении атомам энергии, равной или превышающей энергию соответствующего терма. Подведение этой энергии может осуществляться разнообразными путями: 1) путем столкновения с быстролетящими материальными частицами (электронами, ионами, атомами, молекулами) и перехода их кинетической энергии 2) путем столкновения с уже возбужденными атомами или молекулами и перехода энергии этих квантов в энергию возбуждения рассматриваемых атомов; 3) путем поглощения атомами световых квантов и перехода энергии этих квантов hν в энергию возбуждения атомов; 4) путем перехода в энергию возбуждения энергии, освобождающейся при различных химических реакциях, происходящих с участием рассматриваемых атомов. В реальных источниках происходят все перечисленные процессы. В применяемых на практике источниках − пламени, дуге, искре − доминирующую роль играют процессы соударения с электронами; остальные процессы имеют лишь второстепенное значение. Вещество, приведенное в состояние свечения, может дать информацию о своем составе или строении посредством характеристического излучения. Упорядоченное расположение излучения по длинам волн называют спектром. Атомы каждого элемента характеризуются своим линейчатым спектром, отличным от спектров других атомов. Поэтому, зная длины волн или частоты в оптическом спектре смеси неизвестных элементов, например, сплава металлов, можно однозначно определить, из каких элементов состоит эта смесь. Каждый элемент обладает своим спектром, характерным только для него, т. е. спектр может служить элементу такой же характеристикой, как атомный вес, температура плавления и т. п. На этом основан спектральный анализ, в задачу которого входит определение химического состава вещества.
Возможность проведения спектрального анализа различных химических соединений на составляющие их элементы была впервые доказана Бунзеном и Кирхгофом. Они установили, что при сжигании химических соединений в пламени горелки в спектроскопе видны линии атомов, составляющих эти соединения, но не спектр самих соединений как целого. В дальнейшем было установлено, что при горении электрической дуги или искры также наблюдается линейчатый спектр атомов, из которых состоят электроды: например, если в плазму дугового разряда между угольными электродами ввести последовательно металлический натрий, NaCℓ, Na2SO4 и т. д., то на спектрограммах, кроме других линий, будут присутствовать одни и те же линии натрия. Из этих исследований вытекает основной закон спектрального анализа: 1. При высокотемпературном (3 − 10 тысяч °К) возбуждения различных химических соединений излучаются линейчатые спектры атомов, составляющих эти соединения. 2. Длины волн спектральных линий каждого элемента не зависят от вида химического соединения, введенного в пламя или плазму разряда. Физически этот закон означает, что при достаточно высокой температуре все соединения распадаются на составляющие их атомы, спектр излучения которых мы и наблюдаем. Таким образом, набор спектральных линий однозначно определяет атомы каждого химического элемента. Образно говорят, что спектры-паспорта атомов. Под эмиссионным спектральным анализом понимают совокупность методов определения химического состава вещества по наблюдению его эмиссионного (излучаемого) спектра. Для целей эмиссионного спектрального анализа необходимо возбудить спектр пробы. Чаще всего наиболее подходящим для этого является перевод всей или части пробы в парообразное состояние нагреванием их до достаточно высокой температуры (1000 − 10000 °С). При таких высоких температурах вещество находится в состоянии плазмы. В 1923 году физики Ленгмюр и Тонке назвали плазмой газ в электропроводящем состоянии. Плазма − это смесь электрически заряженных частиц, в которой полная величина отрицательного заряда частиц равна величине полного положительного заряда. Поэтому плазмой является электрически нейтральная система, хорошо проводящая электрический ток. В окружающей нас природе существует естественная плазма. Так вселенная на 99 % находится в состоянии плазмы: звезды, Солнце, межзвездный газ, северное сияние, молнии, шаровые молнии − все это различные виды плазмы, которые можно видеть в естественных условиях. Плазма − проводник тепла и электрического тока. При достаточно высокой степени ионизации плазмы её проводимость достигает значения, которое соответствует проводимости металлических проводников. Плазма под действием электрического и магнитного полей изменяет свои свойства. Под действием электрического поля в плазме появляется электрический ток. В магнитном поле плазма ведет себя как очень своеобразное диамагнитное вещество. Различают высокотемпературную плазму, которая имеет температуру 400 000°С, и низкотемпературную − с температурой до 10 000°С.
В излучающей плазме электрического разряда при атмосферном давлении имеет место термодинамическое равновесие между частицами, и плазму можно характеризовать температурой, одинаковой для всех частиц. Электрические дуги имеют температуру 4 000 − 7 000°С. При возбуждении паров пробы в плазме дугового источника наблюдается три типа спектров: линейчатые, полосатые и сплошные. Линейчатые спектры обязаны своим появлением переходом электронов между энергетическими уровнями возбужденных атомов и ионов. Дискретный характер спектров связан с квантовым характером уровней. Положение и число линий в спектре каждого элемента определяются положением энергетических уровней (термов) в электронной оболочке его атомов. Количественный эмиссионный спектральный анализ есть физический метод определения химического состава вещества, основанный на изучении спектра излучения этого вещества. Задачей такого анализа является определение процентного содержания примесей различных элементов в образце. Количественный спектральный анализ основан на зависимости интенсивности линий от концентрации атомов данного элемента в плазме разряда между электродами. Теоретически эта зависимость выражается соотношением:
где Imn − интенсивность спектральной линии, излучаемой при переходе электрона с орбиты m на орбиту n, Nm − концентрация атомов данного элемента, возбужденных до энергий Wm (до орбиты m), Amn − вероятность перехода электрона m → n, νmn − частота излучаемого света, qm, qn − константы для данных m и n, Wm и Wn − энергии электронов на уровнях m и n, k − постоянная Больцмана, T − абсолютная температура источника излучения. На практике основной рабочей формулой для всех методов количественного спектрального анализа является:
где Iан − интенсивность линии анализируемого элемента,
Iср − интенсивность линии элемента сравнения, причем bан − константа анализируемого элемента для данной линии, cан − концентрация анализируемого элемента в пробе.
Для проведения спектрального анализа достаточно: 1. Испарить исследуемое вещество в пламени Электрической дуги или искры и вызвать излучение его атомов. 2. Разложить свет источника излучения в спектре с помощью спектроскопа или спектрографа. 3. Расшифровать спектр, т. е. найти линии, соответствующие длинам волн, указанным в методике для элемента сравнения и анализируемого элемента. 4. Оценить (визуально или фотографически) относительную интенсивность найденных линий для трех или более образцов с известным содержанием примеси. По найденным значениям 5. Оценить По способам оценки интенсивности методы количественного анализа делятся на визуальные, фотографические и фотоэлектрические. Преимуществом визуальных методов является их быстрота. Время измерений колеблется от 3-х до 9 минут, точность − от 3-х до 7%. Фотографические методы количественного спектрального анализа значительно точнее визуальных, их точность составляет ± 1 − 5% от содержания определяемого элемента, однако время проведения анализа увеличивается до 15 − 30 минут на один элемент. Фотоэлектрические методы анализа сохраняют быстроту определений, присущую визуальным методам, и обладают более высокой чувствительностью, чем фотографические. Так, с использованием квантометра можно производить анализ стали на 10 − 15 элементов с точностью до 0,5%, время проведения анализа − 1 минута. Однако приборы с фотоэлектрической регистрацией весьма сложны и дороги, поэтому чаще применяются визуальные и фотографические методы количественного спектрального анализа.
Цель работы: определить процентное содержание марганца и железа в образцах стали.
Описание установки
Приборы и принадлежности: стилоскоп СЛ − 11А, образец ферромарганца, образцы стали.
Получение и наблюдение эмиссионных спектров сложных веществ осуществляется с помощью специальных спектральных аппаратов. Для визуального спектрального анализа могут быть использованы любые спектроскопы необходимой дисперсии и разрешающей способности. Однако наибольшее применение в промышленности получили приборы двух типов, специально разработанные для спектрального анализа металлов и сплавов: стилоскоп и стилометр. Стилометрами называются спектроскопы, которые позволяют не только рассматривать спектр исследуемого материала, но и производить измерения относительных интенсивностей спектральных линий. Для этого стилометр снабжен клиновым фотометром, который позволяет ослаблять интенсивность спектра в определенное число раз, и устройством для сближения аналитических линий.
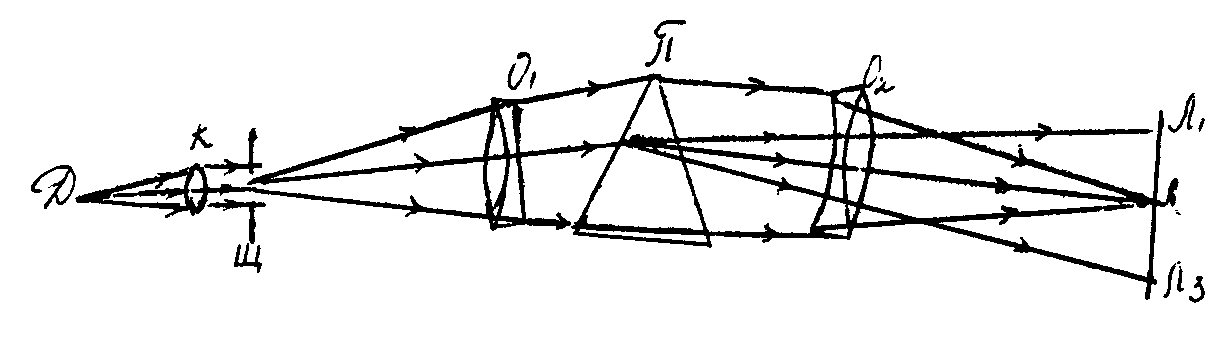
Стилоскоп (от английского «steel» − сталь и греческого «скопейн» − смотреть) служит для полуколичественного спектрального анализа и широко используется в производственной практике при массовых анализах, которые не требуют высокой точности определения концентраций, чаще всего для сортировки сталей. Стилоскопом можно анализировать не только стали, но и самые разнообразные сплавы цветных металлов, твердые сплавы, минералы и другие сложные вещества. Принципиальная оптическая схема стилоскопа приведена на рис. 1.
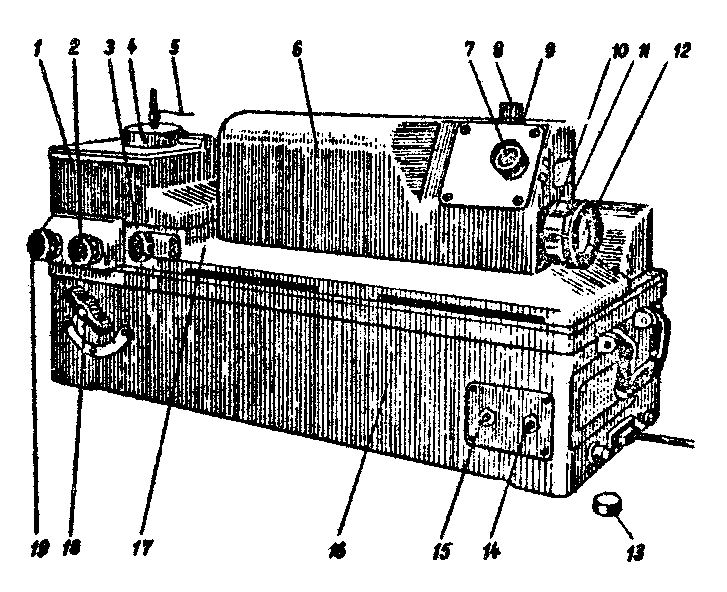
В качестве источников спектров излучения при анализе сталей с помощью стилоскопа используется электрическая дуга (Д) переменного тока. Одним электродом дуги служит медный диск, а другим − анализируемый образец стали. Светящиеся пары электродов дуги излучает свет, направляемый конденсорной линзой «К» на щель стилоскопа. Свет, прошедший через щель «Щ», в виде изображения щели направляется объективом О1 на диспергирующую призму «П». Призма «П» разлагает белый свет на его составляющие. Объектив О2 фокусирует изображение щели стилоскопа в монохроматических лучах, вышедших из призмы «П», на плоскость Л1 − Л2 − Л3 (в виде вертикальных линий различной яркости и цвета). Это эмиссионный линейчатый спектр атомов, содержащихся в анализируемой пробе. Если в состав анализируемого вещества входят несколько химических элементов, то в линейчатом спектре этого вещества можно обнаружить спектральные линии всех элементов. Мерой количества химического элемента в анализируемом веществе является интенсивность спектральных линий этого элемента. Интенсивность спектральной линии пропорциональна количеству одинаковых переходов атомов из возбужденного состояния в невозбужденное. Чем больше какого-либо элемента содержится в анализируемом веществе тем больше одинаковых переходов и, следовательно, ярче (интенсивней) спектральные линии, принадлежащие этому элементу. Однако не все спектральные линии атомного спектра пригодны для спектрального анализа. Для каждого элемента существует ряд линий, которые с уменьшением концентрации элемента в анализируемом веществе гаснут (исчезают) последними. Эти легко возбудимые линии наиболее чувствительны к изменению концентрации. В спектроаналитической практике их называют последними линиями. В эмиссионном спектре каждого химического элемента имеется несколько последних линий. Численные значения длин волн этих линий сведены в специальные таблицы, называемые таблицами спектральных линий. Внешний вид стилоскопа СЛ − 11А приведен на рис. 2. Оптическая система стилоскопа СЛ − 11А размещена в кожухе 6 на плите 17, которая служит основанием прибора. Сбоку на плите 17 помещен столик 1 для анализируемых образцов. Под столиком имеется кронштейн для укрепления стержневого или дискового постоянного электрода. Держатель электродов можно перемещать по высоте маховичком 19, поднимая и опуская медный электрод, тем самым увеличивая или уменьшая расстояние между анализируемым образцом и постоянным медным электродом. В направлении, перпендикулярном оптической оси поворотом рукоятки 3 горящая дуга выводится на оптическую ось прибора. Маховичок 2 служит для поворота рабочей части медного дискового электрода (перед началом работы его следует повернуть необожженной частью вверх). На столик можно устанавливать образцы любых размеров и формы. Для крепления мелких деталей служит пружинный прижим 5. ВНИМАНИЕ! Во время работы рукоятки 3 и 19 не трогать, они поставлены в нужном положении! Спектр рассматривается через окуляр 7. Поворот диспергирующей системы и, следовательно, перемещение спектра в поле зрения окуляра производится маховичком 12. Маховичок 12 соединен с барабаном, на котором нанесена равномерная шкала 10 с ценой деления 2° и шкала 11 с символами химических элементов.
Символами обозначены группы спектральных линий, используемых для анализа сталей на соответствующие примеси. При совмещении символа с остчетным штрихом барабана в поле зрения окуляра появляется соответствующая группа линий. Стилоскоп СЛ − 11А снабжен фотометрическим клином. Фотометрический клин помещен в плоскости изображения спектра и расположен вдоль спектральных линий в виде узкой полоски в центре поля зрения. Перемещение клина производится маховичком 8 и отсчитывается по шкале, которая наблюдается в поле зрения окуляра. В качестве источника возбуждения спектра применяется специальный генератор 16, который расположен в основании 10 прибора. Его питание осуществляется от сети переменного тока напряжением 220 В. Напряжение от генератора к электроду подводится высоковольтным проводом через контакт на кронштейне, а к образцу, установленному на столике, через заземленный корпус прибора (на корпусе стилоскопа имеется специальная клемма «заземление», к которой необходимо подключить заземляющий провод.). На передней панели основания прибора находятся два переключателя: 14 − переключатель режима дуги 2А и 4А; 15 − переключатель для включения и выключения дуги. Выбор режима «дуга» и «искра» производится рукояткой 18.
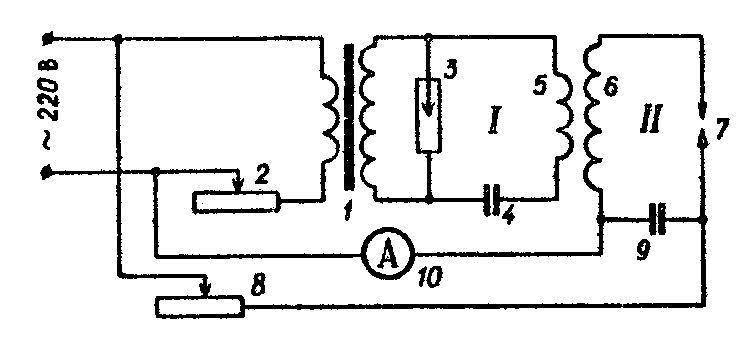
Схема питания дуги переменного тока (генератор дуги ПДГ)
Если электроды дуги присоединить через реостат к источнику переменного тока низкого напряжения, то напряжение на электродах будет непрерывно меняться по абсолютной величине и направлению. Но дуга не возникает, пока промежуток не будет ионизирован. Предположим, что ионизация промежутка произведена в некоторый момент времени. Если сетевое напряжение в этот момент будет больше напряжения зажигания дуги U3, то дуга возникнет и будет гореть до тех пор, пока напряжение на электродах не окажется меньше напряжения горения дуги U2. После этого дуга погаснет. В некоторый последующий момент времени напряжение на электродах опять станет равным напряжению зажигания U3, но дуга сможет загореться только в том случае, если промежуток будет снова ионизирован. Единственный случай, когда можно обойтись без повторной ионизации, это когда дуга горит между угольными электродами при большом токе 8 − 10А. В этом случае благодаря малой теплопроводности угля в момент паузы электроды будут ещё достаточно горячими, чтобы катод мог испускать электроны (эффект термоэмиссии), и поэтому возникает дуга. Если электроды металлические, то требуется повторная ионизация дугового промежутка через каждый полупериод тока, так как в этом случае электроды за время паузы тока настолько охлаждаются, что уже не способны интенсивно испускать электроны в результате термоионной эмиссии. Периодическую ионизацию разрядного промежутка при питании дуги переменного тока низкого напряжения производят при помощи маломощной высоковольтной искры. Принципиальная схема питания дуги переменного тока дана на рис. 3.
При работе трансформатора 1 в контуре I возникает высокочастотный ток порядка 105 герц. Через индуктивную связь катушек 5 и 6 этот высокочастотный ток передается в контур II, где свободно циркулирует по замкнутому контуру: индуктивность 6, разрядный промежуток 7, емкость 9, если только в этом контуре величина промежутка между электродами допускает прохождение в нем высокочастотного искрового разряда. Если на контур II подать одновременно переменный ток низкого напряжения, то возникает дуговой разряд, который длится некоторую часть полупериода переменного напряжения. Роль высокочастотного разряда заключается в зажигании дуги каждый раз, когда она тухнет при переходе напряжения через нуль. Сила тока и температура искрового и дугового разряда зависят от состояния электродов, поэтому для получения воспроизводимых результатов необходимо свежезачищенные электроды предварительно обыскривать 1 − 2 минуты. За это время вся рабочая поверхность электродов покрывается равномерным слоем окисленного металла, после чего интенсивность линий, излучаемых разрядом, сохраняется постоянной во времени. При работе с искровым и дуговым генераторами следует строго соблюдать правила безопасности. При работе искрового генератора мощность разряда в импульсе очень велика: при напряжении 12 − 15 тысяч вольт сила тока составляет 2 − 5 ампер, т. е. выделяется энергия до 60 кВт. Этого более чем достаточно для нанесения необратимых травм. Открывать крышки генератора и менять образцы и электроды можно только при выключенном приборе!
Методика полуколичественного определения марганца в стали
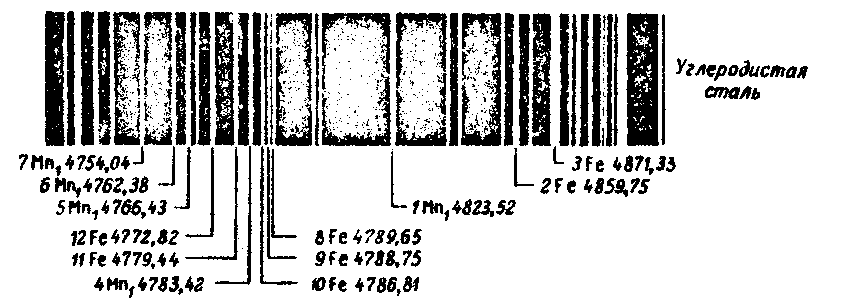
В настоящей работе предлагается провести на стилоскопе полуколичественный спектральный анализ стали на марганец и железо. Изучая спектр стали прежде всего необходимо отыскать в нем последние линии марганца. Это есть качественный анализ, дающий право утверждать, что в анализируемом веществе имеется интересующий нас элемент. Качественный анализ стали производится путем визуального сравнения её спектра со спектром марганца. Для этого в качестве одного из электродов дуги берут ферромарганец, который содержит до 80% марганца. Образец ферромарганца устанавливают на столик стилоскопа, зажигают дугу и, наблюдая его спектр в различных областях, легко обнаруживают яркие линии марганца. Фиксируют положение этих линий с помощью цифровой шкалы на барабане 12. Затем образец ферромарганца заменяют образцом стали и, пользуясь шкалой барабана 12, проверяют наличие спектральных линий интересующего нас марганца в изучаемом образце стали. Аналогичным образом в образцах стали определяются легирующие добавки хрома, вольфрама и т. д. Приближенное количественное (т. е. полуколичественное) определение марганца в сплаве основано на визуальной оценке соотношения интенсивности одной из последних спектральных линий марганца и последней линии основного химического элемента стали-железа. Эти линии называют аналитическими линиями. При определении содержания марганца в углеродистых сталях в интервале концентраций от 0,3% до 2,0% в качестве аналитической пары используются спектральная линия марганца − 482,35 нм и спектральная линия железа − 485,97 нм, которые расположены в зеленовато-голубой области спектра (рис. 4).
Очень простое соотношение интенсивностей этих линий, определенное визуально, позволяет однозначно осуществлять полуколичественный анализ углеродистых сталей на марганец. Вот эти соотношения: а) если в образце стали марганца больше 0,3%, но меньше 0,5%, интенсивность линий марганца меньше интенсивности линий железа; б) если в образце стали содержание марганца больше 0,6%, но меньше 0,8%, то интенсивности линий марганца и железа равны; в) если в образце стали содержание марганца больше 1,0%, но меньше 2,0%, то интенсивность линии марганца больше интенсивности линии железа. Эти соотношения принято записывать кратко в следующем виде:
0,3 0,5% 1Mn < 2Fe 0,6 0,8% 1Mn = 2Fe 1,0 2,0% 1Mn > 2Fe 3,0 4,0% 1Mn = Fe
Производство работы
Задание № 1. Провести качественный спектральный анализ образцов углеродистой стали на марганец. 1. Поставить переключатель 18 в положение «дуга», переключатель 14 − в положение 4А. 2. Укрепить окуляр в гнезде 7; переключатель 8 поставить так, чтобы белая точка на нем была против отметки 20Х. 3. Положить образец ферромарганца на столик стилоскола так, чтобы он, перекрывая прорезь, зачищенным участком поверхности был обращен к медному электроду. 4. Включить дугу, поставив переключатель 12 в положение «вкл». 5. Наблюдая спектр в течение 1 − 2х минут через окуляр 7 и вращая его вокруг оси, добиться резкого изображения линейчатого спектра.
ПРИМЕЧАНИЕ: 1) Чтобы не обгорали и излишне не нагревались медный электрод и образец рекомендуется зажигать дугу на 1 − 2 минуты с перерывами 2 − 3 минуты. 2) Во время изучения спектра нельзя поворачивать медный электрод рукояткой 2. Это следует делать перед очередным включением дуги.
6. Включить дугу. Наблюдать спектр ферромарганца, вращая барабан 12. Отыскать в спектре ферромарганца три близко расположенные друг к другу яркие линии марганца в красной области, а затем одну из линий марганца в зеленовато-голубой области (на элементной шкале барабана 12 должен стоять символ Mn1). Проделать наблюдения несколько раз, используя указатель-стрелку, который введен в окуляр. Показания цифровой шкалы барабана 12, соответствующие положению четырех наблюдаемых линий, записать в таблицу. 7. Заменить образец ферросплава на столике стилоскопа образцом углеродистой стали. Пользуясь сделанными в таблице записями, указывающими положение в спектре четырех спектральных линий марганца, осуществить качественный анализ этого образца углеродистой стали: проверить есть ли в исследуемом образце марганец, т. е. присутствуют ли в спектре образца линии марганца. Данные занести в таблицу. Внимательно посмотрев рисунок 4, в зеленовато-голубой области спектра образца стали найти аналитическую линию железа (485, 97 нм). Положение этой линии в делениях цифровой шкалы барабана 12 записать в таблицу.
Задание №2. Провести полуколичественный спектральный анализ углеродистой стали на марганец. В оставшихся выданных вам образцам углеродистой стали определить приблизительное содержание марганца по схеме, приведенной ранее. 1. Образец положить на столик стилоскопа зачищенной поверхностью к медному электроду. 2. На барабане 12 выставить зеленовато-голубую область спектра, что соответствует на элементной шкале символу − Mn1, а на цифровой − интервалу 96 − 100 делений. 3. Включить дугу. Сравнить интенсивности аналитических спектральных линий Mn − 482,35 нм и Fe − 485,97 нм. Записать в таблицу, сделав вывод о процентном содержании марганца в образце. 4. П. п. 1, 2, 3 повторить для других образцов углеродистой стали. Данные занести в таблицу. Таблица
Сделать вывод о процентном содержании марганца и железа в исследуемых образцах стали.
Контрольные вопросы
1. Линейчатый спектр атома водорода. Серии Лаймана, Бальмера, Пашена. Сериальная формула. 2. Постулаты Бора. Спектральный терм. Главное квантовое число. 3. Способы перевода атомов в возбужденное состояние. Пламя, дуга, искра как источники энергии. 4. Спектральный анализ. Законы спектрального анализа. Плазма. Методы количественного анализа. 5. Решить задачу.
Оптический квантовый генератор (ОКГ)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 77; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.83.150 (0.102 с.) |
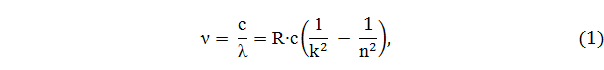

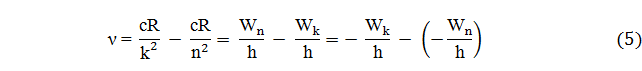

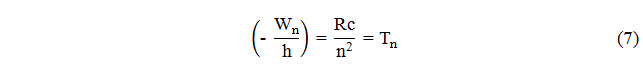
 в энергию возбуждения;
в энергию возбуждения;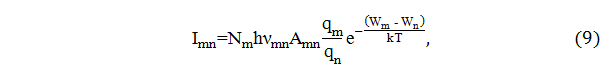

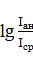 не зависит от условий возбуждения,
не зависит от условий возбуждения,