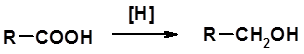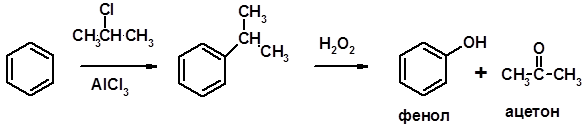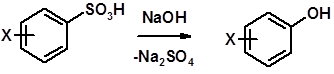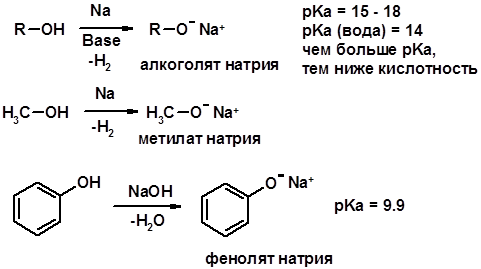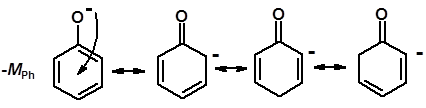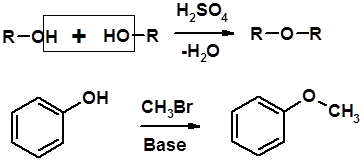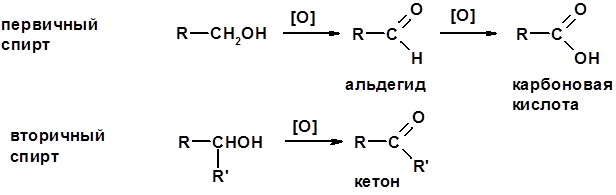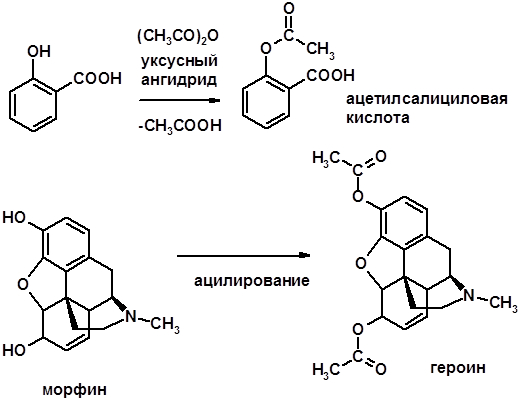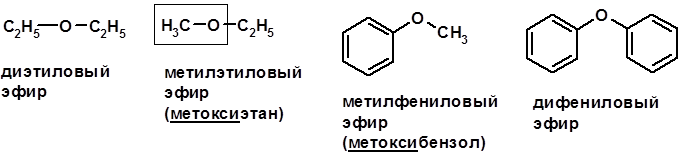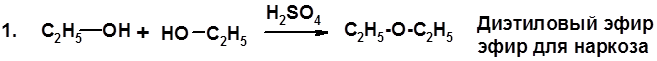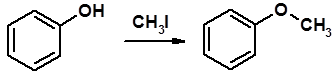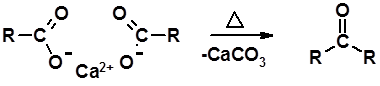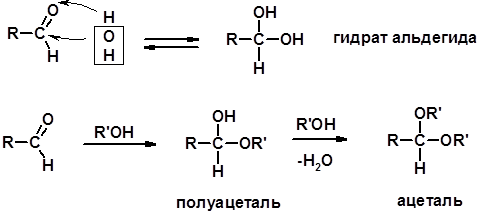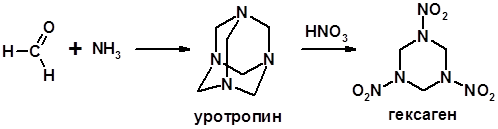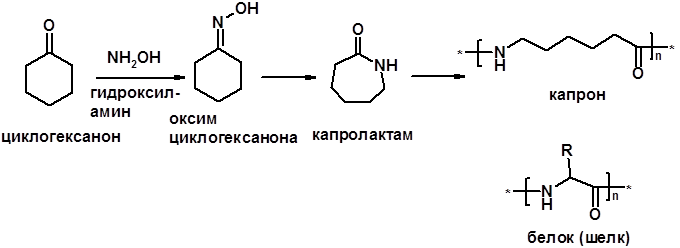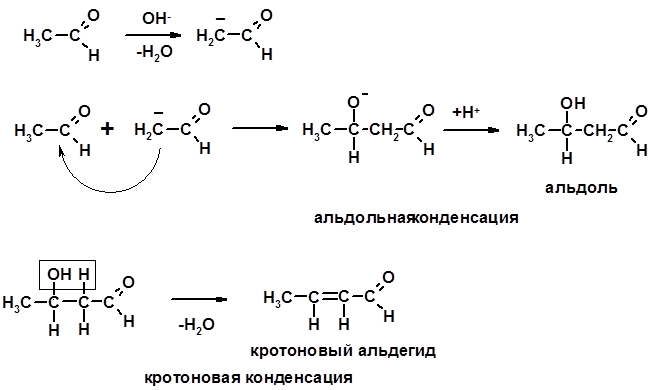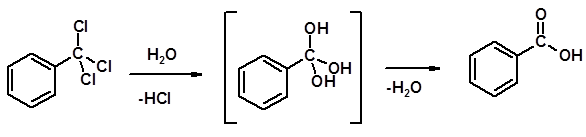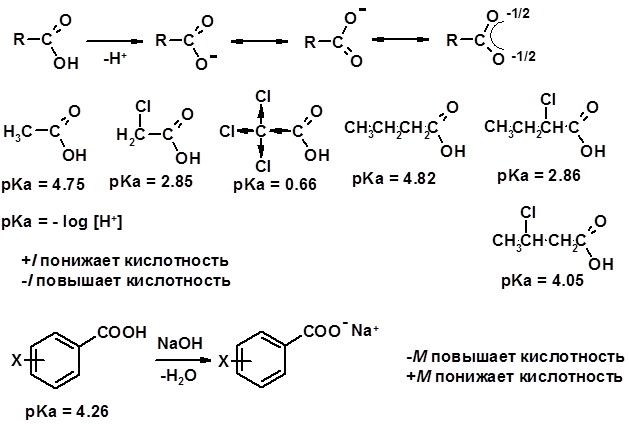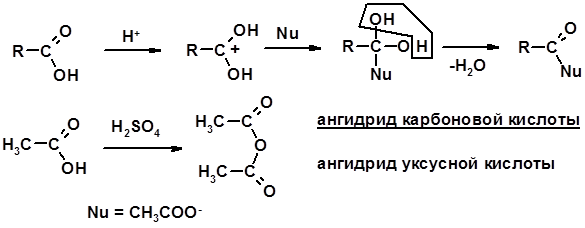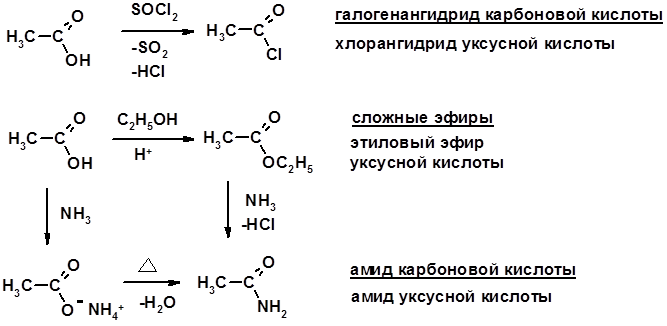Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Получение галогенуглеводородов (продолжение)
5. Галогенирование аренов (см. хлорирование аренов) Химические свойства 1. Отщепление галогеноводорода (см. получение алкенов и алкинов) 2. Реакция Вюрца (см. получение алканов) 3. Нуклеофильное замещение галогена (для алифатических галогенуглеводородов)
Реакцию можно рассматривать как введение остатка алифатического углеводорода (алкила) в другую молекулу – реакция алкилирования, а галогенуглеводород – алкилирующий агент
4. Ароматическое нуклеофильное замещение - возможно только для активированных сильными акцепторами (нитро-группа) аренов
5. Получение магнийорганических соединений (реактивов Гриньяра)
СПИРТЫ и ФЕНОЛЫ (ОН – гидроксил или гидрокси-группа) (приставка для обозначения гидроксила – гидрокси, суффикс – ол)
Методы получения Получение спиртов Гидратация алкенов (см. алкены) Замещение галогена на гидроксил (OH) (см. галогенуглеводороды) Восстановление карбоновых кислот
Получение фенолов Кумольный метод получения фенола в промышленности
Сплавление сульфокислот с щелочами
Химические свойства Кислотность (способность отдавать протон)
Кислотность фенолов выше, чем алифатических спиртов Кислотность тем выше, чем выше стабильность образующегося аниона Стабильность заряженной частицы тем выше, чем выше делокализация заряда
2. Реакции спиртов с галогеноводородами (SN) (см. получение галогенугдеводородов) 3. Образование простых эфиров
4. Образование сложных эфиров (этерификация)
Окисление спиртов
Окисление 1,2- и 1,4-дигидроксибензолов
Электрофильное ароматическое замещение в фенолах ОН –заместитель I рода, направляет реакцию в орто - и пара -положения
Ацилирование фенолов Простые эфиры
Методы получения
Алкилирование спиртов и фенолов
Эфиры – довольно стабильные соединения и используются как растворители. Расщепляются до исходных спиртов лишь в жестких условиях Карбонильные соединения – альдегиды и кетоны
Методы получения Окисление первичных и вторичных спиртов (см. спирты) Озонолиз алкенов (см. алкены)
Пиролиз кальциевых и бариевых солей карбоновых кислот
4. Ацилирование по Фриделю-Крафтсу (см. свойства аренов) Восстановление карбоновых кислот и их производных
Химические свойства 1. Реакции с водой и спиртами
Реакции с аммиаком
3. Реакции с аминами и их производными (присоединение-отщепление)
4. Конденсации СН-кислотность – карбонильные соединения способны отдавать протон от a -углеродного атома
Если нет протона в a-положении, то происходит реакция Каниццарро
5. Окислительно-восстановительные реакции
Карбоновые кислоты
Методы получения 1. Окисление первичных спиртов и альдегидов 2. Гидролиз трихлорметильных производных аренов
3. Гидролиз сложных эфиров (омыление)
Химические свойства Карбоновых кислот 1. Кислотность (образуют соли в реакциях даже со слабыми основаниями)
2. Реакции с нуклеофилами
Углерод карбоксильной группы малоактивен по отношению к нуклеофилам (по сравнению с карбонильной группой) из-за + М гидроксила, для активации карбоновых кислот применяют протонирование, вносящее положительный заряд
|
|||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 151; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.105.124 (0.008 с.) |