Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ый курс лечебное делоСтр 1 из 5Следующая ⇒
Ый курс Лечебное дело Задание №2. Катионы первой аналитической группы.
Выполнить лабораторую работу: Первая аналитическая группа катионов (Na+, K+, NH4+). Соли натрия, калия, аммония, а также их гидроксиды, в большинстве случаев хорошо растворимы в воде, что обусловливает отсутствие для них группового реагента.
Частные реакции катиона Na+. 1.Реакция с дигидроантимонатом калия KH2 SbO4. Катионы натрия с дигидроантимонатом калия в нейтральных и слабощелочных растворах образуют белый кристаллический осадок NaH2SbO4. NaNO3 + KH2SbO4 = NaH2SbO4↓+ KNO3 Выполнение опыта: к 3-4 каплям нитрата натрия прибавляем 3-4 капли дигидроантимоната калия KH2SbO4 и для ускорения протекания реакции создаём дополнительные центры кристаллизации (потрите стеклянной палочкой о стенки пробирки). Реакция имеет невысокую чувствительность, поэтому концентрация ионов натрия в растворе должна быть высокая, а среда раствора должна быть нейтральная или слабощелочная. Открытию ионов натрия данной реакцией мешают следующие ионы: Ba2+, Sr2+, Ca2+, Pb2+, [Hg2]2+.
Окрашивание пламени. Предварительно подготовленную платиновую или нихромовую проволоку смачиваем исследуемым раствором (NaNO3) и внесим в бесцветное пламя горелки. Пламя горелки окрашивается в жёлтый цвет. О присутствии ионов натрия можно судить в том случае, если окраска пламени не исчезает в течение 15 секунд. Спред= 1·10-8 г/мл.
Частные реакции катиона K+. 1.Реакция с гидротартратом натрия NaHC4 H4 O6. Катионы калия с гидротартратом натрия образуют белый кристаллический осадок KHC4H4O6. KNO3 + NaHC4H4O6 = KHC4H4O6↓+ NaNO3 Выполнение опыта: к 3-4 каплям нитрата калия прибавляем 3-4 капли гидротартрата,натрия NaHC4H4O6, перемешиваем содержимое пробирки стеклянной палочкой, а также можно создать дополнительные центры кристаллизации (потереть стеклянной палочкой о стенки пробирки).. Реакция имеет невысокую чувствительность (Спред= 5·10-4 г/мл), поэтому концентрация ионов калия в растворе должна быть высокая, а среда раствора должна быть нейтральная. Открытию ионов калия данной реакцией мешают следующие ионы: Ba2+, Ca2+, Pb2+, NH4+.
2.Реакция с гексанитрокобальтатом (III) натрия Na3[ Co(NO2)6].
Катионы калия с гексанитрокобальтатом (III) натрия образуют жёлтый кристаллический осадок K2Na[Co(NO2)6]. 2KNO3 + Na3[Co(NO2)6 = K2Na[Co(NO2)6]↓+ 2NaNO3 Выполнение опыта: к 3-4 каплям нитрата калия прибавляем 3-4 капли гексанитрокобальтата (III) натрия Na3[Co(NO2)6]. Спред= 1,3·10-5 г/мл. Следует помнить, что гексанитрокобальтат (III) натрия в растворе быстро разлагается и бурая окраска переходит в розовую. Открытию ионов калия данной реакцией мешают следующие ионы: Pb2+, [Hg2]2+, Ag+, NH4+.
Микрокристаллоскопическая реакция. Катионы K+ с гексанитрокупратом (II) свинца (II) натрия образуют кубические кристаллы чёрного цвета. 2KNO3 + Na2Pb[Cu(NO2)6] →K2Pb[Cu(NO2)6] + 2 NaNO3. Выполнение опыта: на предметное стекло наносим каплю исследуемого раствора и досуха выпариваем её на пламени горелки. После того как соль остынет, обрабатываем её гексанитрокупратом (II) свинца (II) натрия и образовавшиеся кристаллы рассматриваем под микроскопом. По периферии кристаллы образуются в первую очередь, а в центре капли кристаллы появляются позже. Открытию ионов калия данной реакцией мешают следующие ионы NH4+.
Окрашивание пламени. Предварительно подготовленную платиновую и нихромовую проволоку смачиваем исследуемым раствором (КNO3) и внесим в бесцветное пламя горелки. Пламя горелки окрашивается в фиолетовый цвет. О присутствии ионов калия можно судить в том случае, если окраска пламени не исчезает в течение 15 секунд. Спред= 1·10-8 г/мл.
Частные реакции катиона NH4+. Ый курс Лечебное дело
Задание № 3. Некоторые качественные реакции на катионы и анионы Ca2+; Fe2+; Fe3+; SO42-; PO43-; NO3-. 1.Микрокристаллоскопическая реакция на катион Ca2+. Катионы кальция Ca2+ с сульфат-ионами образует труднорастворимую соль CaSO4: Ca2+ + SO42-→ CaSO4↓ Выполнение опыта: на предметное стекло помещаем каплю раствора Сa(NO3)2, добавляем каплю 2 н. раствора серной кислоты и осторожно нагреваем на маленьком пламени газовой горелки до появления белой каймы. По краям капли образуются игольчатые кристаллы в виде пучков или звёздочек. 2. Окрашивание пламени катионом Ca2+.
Соли кальция при внесении в бесцветное пламя газовой горелки окрашивают пламя в кирпично-красный цвет. Методика выполнения опыта аналогична, изложенной выше, для других катионов.
3. Реакция на катион Ca2+ с гексацианоферратом (II) калия (жёлтая кровяная соль). Катионы кальция Ca2+ в аммиачном буферном растворе с Ca2+ со свежеприготовленным насыщенным раствором гексацианоферрата (II) калия образует труднорастворимую соль (NH4)2Ca[Fe(CN)6]: 2NH4+ + Ca2++ [Fe(CN)6]4- → (NH4)2Ca[Fe(CN)6]. Выполнение опыта: к 3-4 каплям насыщенного раствора нитрата кальция добавляем 2-3 капли раствора аммиака, 3-4 капли раствора хлорида аммония. Смесь нагреваем до кипения, затем прибавляем 5-6 капель свежеприготовленного насыщенного раствора гексацианоферрата (II) калия. Выпадает белый кристаллический осадок гексацианоферрата (II) аммония и кальция.
4.Реакция на катион Fe2+ с гексацианоферратом (III) калия (красная кровяная соль). Соли катиона железа (II) легко окисляются в растворе кислородом воздуха, поэтому раствор сульфата железа (II) готовим перед проведением реакций. Гексацианоферрат (III) калия с катионом Fe2+ образует синий осадок турнбулевой сини (гексацианоферрат (III) железа (II)). 3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2. Выполнение опыта: к 2-3 каплям раствора соли железа (II) добавляем 2-3 капли раствора красной кровяной соли. Осадок не растворяется в кислотах. 5.Реакция на катион Fe3+ с гексацианоферратом (II) калия (жёлтая кровяная соль). Растворы солей железа (III) имеют жёлтую или красно-бурую окраску из-за частичного гидролиза. Гексацианоферрат (II) калия с катионом Fe3+ образует тёмно-синий осадок берлинской лазури (гексацианоферрат (II) железа (III)): 3Fe3+ + 2[Fe(CN)6]4- → Fe4[Fe(CN)6]3. Выполнение опыта: к 2-3 каплям раствора соли железа (III) добавляем 3-4 капли дистиллированной воды и 2 капли раствора жёлтой кровяной соли. Реакцию можно проводить капельным методом на фильтровальной бумаге или на предметном стекле.
6. Реакция на катион Fe3+ с роданидом аммония (калия, натрия). Роданид-ион с катионами Fe3+ образует растворимый комплекс кроваво-красного цвета: [Fe(H2O)6]3+ + nSCN- → [Fe(SCN)n(H2O)6-n ]3-n + nH2O Выполнение опыта: к 2-3 каплям раствора соли железа (III) добавляем 3-4 капли дистиллированной воды и 2 капли раствора роданида аммония (калия, натрия). Реакцию лучше проводит при рН<3. Для полноты протекания реакции лучше использовать концентрированные растворы роданида.
7.Реакция на анион SO42- с хлоридом (нитратом) бария. Сульфат-ион с катионами Ва2+ образует белый кристаллический осадок: Ва2+ + SO42- → ВаSO4↓ Выполнение опыта. К 3-4 каплям раствора сульфата натрия (калия) добавьте каплю разбавленного раствора HCl, 2-3 капли раствора хлорида (нитрата) бария. Выпадает белый кристаллический осадок. Испытайте растворимость выпавшего осадка в растворах азотной, соляной, уксусной кислотах и в растворе аммиака.
8.Реакция на анион Р O43- с нитратом (хлоридом) бария. Ортофосфат- и гидроортофосфат-ионы с катионами бария образуют белый осадок, растворимые в азотной, соляной, уксусной кислотах: 2PO43- + 3Ba2+ → Ba3(PO4)2↓ HPO42- + Ba2+ → BaHPO4↓ Гидроортофосфат-ион в присутствии аммиака с катионами бария образует осадок ортофосфата бария: 2HPO42- + 3Ba2+ + 2NH3 → Ba3(PO4)2↓ + 2NH4+ Выполнение опыта: к 4-6 каплям гидроортофосфата натрия добавить 2-3 капли раствора аммиака и по каплям раствор соли бария до прекращения образования белого осадка. К полученному осадку прикапать раствор соляной кислоты до полного его растворения.
9.Реакция на анион Р O43- с нитратом серебра. Ортофосфат- и гидроортофосфат-ионы с катионами серебра в нейтральной среде образуют белый осадок, растворимый в азотной кислоте и в концентрированном растворе аммиака: 2PO43- + 3Ag+ → Ag3PO4↓ HPO42- + 3Ag+ → Ag3PO4↓ + H+ Выполнение опыта: к 4-6 каплям гидроортофосфата или ортофосфата натрия добавить по каплям раствор нитрата серебра до прекращения выпадения жёлтого осадка.
Задание №4. Кислотно-основное титрование. Задание №5-6. Перманганатометрия. Задание №7. Подготовка к контрольной работе. Примерный вариант контрольной работы.
1.Рассчитайте рН: а) 0,02 М раствора гидроксида натрия (с учётом и без учёта ионной силы раствора); б) 0,2 М раствора муравьиной кислот(Ка(НСООН)=1,8·10-4.
2.Рассчитать титр раствора азотной кислоты и титр её по оксиду натрия, если для приготовления 1 л этого раствора было взято 15 мл 55,80%-ного раствора азотной кислоты (плотность 1,35 г/мл).
3.Навеска уксусной кислоты массой 2,0000 г растворена в мерной колбе V=200 мл. На титрование 40 мл этого раствора израсходовали 31 мл раствора NaOH (Т(NaOH)=0,004088 г/мл). Вычислить массовую долю CH3COOH в исходной навеске.
4.Какая масса нитрита натрия содержится в 100 мл раствора, если на титрование 15 мл его раствора было израсходовано 19,5 мл 0,1 н. раствора перманганата калия в кислой среде?
Задание №8. Фотометрия. Фотометрическое определение меди в виде аммиаката. Решить задачи: 1. Пропускание раствора KMnO4 с концентрацией 5 мкг/см3, измеренное в в кювете толщиной 2 см при 520 нм, равно 0,400. Рассчитайте молярный коэффициент поглощения KMnO4. Ответ: 6000.
2. Коэффициент молярного поглощения комплекса Fe(SCN)2+ при 580 нм равен 6000. Рассчитайте оптическую плотность 3·10-5 моль/дм3 раствора комплекса, измеренную при 580 нм с толщиной кюветы 2,0 см. Ответ: 0,3.
3. Пропускание раствора с концентрацией вещества 3,2 мг Al в 100 мл, измеренное при 480 нм в кювете толщиной 2 см, равно 34,6%. Рассчитайте молярный коэффициент поглощения этого вещества. Ответ: 196.
Все фотометрические определения проводят по единой схеме: 1. Переведение пробы анализируемого вещества в раствор. 2. Получение окрашенной аналитической формы в результате проведения цветной реакции.
3. Измерение светопоглощения раствора аналитической формы. 4. Обработка полученных данных. Измерение поглощения проводят с помощью фотоэлектроколориметров. Фотоэлектроколориметрия – анализ на основе измерения поглощения некоторого монохроматического излучения. В видимой части спектра воспринимаемый цвет – результат поглощения веществом определенного участка сплошного спектра электромагнитного излучения (белого цвета). Цвет раствора всегда является дополнительным к цвету поглощенного излучения. Регистрация аналитического сигнала осуществляется с помощью однолучевых или двухлучевых с компенсационной схемой фотоэлектроколориметров (ФЭК). Принцип измерения заключается в сравнении интенсивностей световых потоков, проходящих через раствор сравнения и исследуемый раствор.
Порядок работы на колориметре КФК-2.
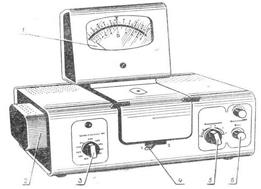
1 – микроамперметр со шкалой, оцифрованной в коэффициентах пропускания (Т) и оптической плотности (D); 2 – защитный кожух для осветителя; 3 – ручка пере-ключения свето-фильтров; 4 – ручка для переключения кювет в световом пучке; 5 – ручка изменения чувствительности фотоэлемента; 6 – ручка установки 0 (100%). Измерения на колориметре следует проводить при температуре окружающего воздуха от 10 до 35ºС. При измерении со светофильтрами 315, 364, 400, 440, 490, 540 нм, отмеченными на лицевой панели колориметра черным цветом, ручку ЧУВСТВИТЕЛЬНОСТЬ (5) устанавливать в одно из положений «1», «2», «3», отмеченных на лицевой панели также черным цветом. При измерении со светофильтрами 590, 670, 750 нм отмеченными на лицевой панели колориметра красным цветом, ручку ЧУВСТВИТЕЛЬНОСТЬ (5) устанавливать в одно из положений «1», «2», «3», отмеченных на лицевой панели также красным цветом. Рабочие поверхности кювет перед каждым измерением тщательно протираются фильтровальной бумагой, при установке кювет нельзя касаться пальцами рабочих участков поверхностей (ниже уровня жидкости в кювете). Наливать жидкость в кюветы необходимо до метки на боковой стенке. После завершения работ на колориметре до его выключения ручку ЧУВСТВИТЕЛЬНОСТЬ установить в положение «1», обозначенное красным цветом, а ручку УСТАНОВКА 100 ГРУБО – в крайнее левое положение. Подготовка к работе. 1. Колориметр включить в сеть за 15 минут до начала измерений. Во время прогрева кюветное отделение должно быть открыто. 2. Ввести необходимый по роду измерения цветной светофильтр (590 нм). 3. Установить чувствительность колориметра в положение «3», отмеченное красным цветом. Измерение коэффициента пропускания. 1. В кюветный отсек поместить подставку с кюветами. В дальний отсек закрепить кювету с растворителем, а в ближний – кювету с исследуемым раствором. 2. В световой пучок вращением ручки 4 поместить кювету с растворителем (вода). 3. Закрыть крышку кюветного отделения. 4. Ручками ЧУВСТВИТЕЛЬНОСТЬ и УСТАНОВКА 100 ГРУБО и ТОЧНО установить отсчет 100 по шкале колориметра. Ручка ЧУВСТВИТЕЛЬНОСТЬ может находиться в одном из трех положений «1», «2» или «3», отмеченных красным цветом.
5. Поворотом ручки 4 кювету с растворителем заменить кюветой с исследуемым раствором. 6. Снять отсчет по верхней шкале коэффициентов пропускания колориметра (Т, в %). ый курс Лечебное дело Задание №2. Катионы первой аналитической группы.
Выполнить лабораторую работу: Первая аналитическая группа катионов (Na+, K+, NH4+). Соли натрия, калия, аммония, а также их гидроксиды, в большинстве случаев хорошо растворимы в воде, что обусловливает отсутствие для них группового реагента.
Частные реакции катиона Na+. 1.Реакция с дигидроантимонатом калия KH2 SbO4. Катионы натрия с дигидроантимонатом калия в нейтральных и слабощелочных растворах образуют белый кристаллический осадок NaH2SbO4. NaNO3 + KH2SbO4 = NaH2SbO4↓+ KNO3 Выполнение опыта: к 3-4 каплям нитрата натрия прибавляем 3-4 капли дигидроантимоната калия KH2SbO4 и для ускорения протекания реакции создаём дополнительные центры кристаллизации (потрите стеклянной палочкой о стенки пробирки). Реакция имеет невысокую чувствительность, поэтому концентрация ионов натрия в растворе должна быть высокая, а среда раствора должна быть нейтральная или слабощелочная. Открытию ионов натрия данной реакцией мешают следующие ионы: Ba2+, Sr2+, Ca2+, Pb2+, [Hg2]2+.
Окрашивание пламени. Предварительно подготовленную платиновую или нихромовую проволоку смачиваем исследуемым раствором (NaNO3) и внесим в бесцветное пламя горелки. Пламя горелки окрашивается в жёлтый цвет. О присутствии ионов натрия можно судить в том случае, если окраска пламени не исчезает в течение 15 секунд. Спред= 1·10-8 г/мл.
Частные реакции катиона K+. 1.Реакция с гидротартратом натрия NaHC4 H4 O6. Катионы калия с гидротартратом натрия образуют белый кристаллический осадок KHC4H4O6. KNO3 + NaHC4H4O6 = KHC4H4O6↓+ NaNO3 Выполнение опыта: к 3-4 каплям нитрата калия прибавляем 3-4 капли гидротартрата,натрия NaHC4H4O6, перемешиваем содержимое пробирки стеклянной палочкой, а также можно создать дополнительные центры кристаллизации (потереть стеклянной палочкой о стенки пробирки).. Реакция имеет невысокую чувствительность (Спред= 5·10-4 г/мл), поэтому концентрация ионов калия в растворе должна быть высокая, а среда раствора должна быть нейтральная. Открытию ионов калия данной реакцией мешают следующие ионы: Ba2+, Ca2+, Pb2+, NH4+.
2.Реакция с гексанитрокобальтатом (III) натрия Na3[ Co(NO2)6]. Катионы калия с гексанитрокобальтатом (III) натрия образуют жёлтый кристаллический осадок K2Na[Co(NO2)6]. 2KNO3 + Na3[Co(NO2)6 = K2Na[Co(NO2)6]↓+ 2NaNO3 Выполнение опыта: к 3-4 каплям нитрата калия прибавляем 3-4 капли гексанитрокобальтата (III) натрия Na3[Co(NO2)6]. Спред= 1,3·10-5 г/мл. Следует помнить, что гексанитрокобальтат (III) натрия в растворе быстро разлагается и бурая окраска переходит в розовую. Открытию ионов калия данной реакцией мешают следующие ионы: Pb2+, [Hg2]2+, Ag+, NH4+.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 66; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.153.38 (0.094 с.) |