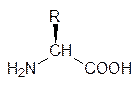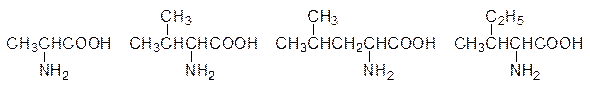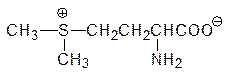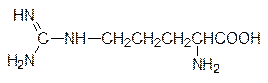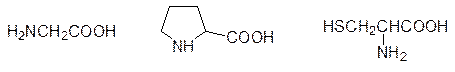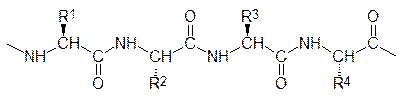Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 4. Аминокислоты, пептиды и белки
Аминокислоты Все разнообразие веществ пептидной природы основано на 20 аминокислотах, называемых белковыми аминокислотами. Обязательным структурным элементом у них является атом углерода, к которому присоединена аминогруппа и карбоксильная группа, то есть они являются a-аминокислотами. У 19 аминокислот несущий аминогруппу и карбоксильную группу атом углерода замещен еще одним радикалом, из-за чего этот атом становится асимметрическим. Среди белковых аминокислот есть как левовращающие (гистидин, пролин, серин, треонин, фенилаланин), так и правовращающие (аланин, аргинин, глютаминовая кислота, изолейцин, лизин), но все белковые аминокислоты имеют одинаковую пространственную конфигурацию по этому асимметрическому атому углерода. Величина и знак удельного вращения используются в аналитических целях, но при изучении строения производных хиральных молекул гораздо важнее их абсолютная конфигурация. При рассмотрении пространственной конфигурации углеводов стереоизомеры глицеринового альдегида были представлены в виде фишеровских плоскостных структур. Методом рентгеноструктурного анализа установлено, что у тетраэдрического sp 3-гибридизованного атома углерода при левом расположении гидроксильной группы у левовращающего глицеринового альдегида формильная группа и гидроксиметильная группа расположены за плоскостью, проходящей через асимметрический атом углерода, а атом водорода и гидроксильная группа направлены вперед:
От глицеринового альдегида можно без обращения конфигурации, окислив альдегидную группу до карбоксильной, восстановив гидроксиметильную группу до метильной и заменив гидроксигруппу на аминогруппу, перейти к простейшей аминокислоте с асимметрическим атомом углерода – аланину. При таком превращении оказывается, что выделяемый из белков аланин соответствует по конфигурации L ‑глицериновому альдегиду. То же самое получится и для 18 других оптически активных аминокислот. Две белковые аминокислоты – треонин и изолейцин – имеют еще один асимметрический атом углерода, но и здесь в живой природе встречается только один диастереомер, хотя обычный синтез приводит с равной вероятностью к образованию четырех изомеров, представляющих собой две пары диастереомеров.
В химии аминокислот более удобно изображать пространственное строение этих соединений, помещая в одну плоскость аминогруппу и карбоксильную группу. Тогда атом водорода у L -аминокислот будет расположен за этой плоскостью, а группа R перед ней:
Существуют различные классификации белковых аминокислот по заместителям в радикале R, но проще всего различать аминокислоты с нейтральными, кислыми и основными группами в остатках, соединенных с атомом углерода, несущим аминогруппу и карбоксильную группу. К аминокислотам с нейтральными радикалами R относятся глицин (Гли, Gly, G), аланин (Ала, Ala, A), валин (Вал, Val, V), лейцин (Лей, Leu, L), изолейцин (Иле, Ile, I), метионин (Мет, Met, M), серин (Сер, Ser, S), треонин (Тре, Thr, T), цистеин (Цис, Cys, C), фенилаланин (Фен, Phe, F), тирозин (Тир, Tyr, Y), триптофан (Трп, Trp, W), аспарагин (Асн, Asn, N), глютамин (Глн, Gln, Q), пролин (Про, Pro, P). В некоторых классификациях перечисленные аминокислоты подразделяют на полярные и неполярные, но такое выделение неизбежно будет носить субъективный характер. Аминокислоты с карбоксильными группами в радикале R (кислые аминокислоты) – это аспарагиновая кислота (Асп, Asp, D) и глютаминовая кислота (Глу, Glu, E). И, наконец, аминокислоты с основными группами в радикале R – это гистидин (Гис, His, H), лизин (Лиз, Lys, K) и аргинин (Арг, Arg, R). Обозначения аминокислот трехбуквенными символами используются для краткого изображения олигопептидов, а для полипептидов и белков даже такие символы оказались слишком длинными и сейчас чаще всего используют однобуквенные символы. Названия аминокислот сложились исторически от греческих корней. Так, глицин, выделенный из продуктов гидролиза желатина, имеет сладкий вкус (гликос); лейцин (лейкос – белый) был выделен из мышечной ткани, тирозин (тирос – сыр) – из казеина, цистин – продукт окисления цистеина – из камней мочевого пузыря (кистос – пузырь) и т.д. Понятно, что большие молекулы пептидов и белков могут сворачиваться в компактные образования, стабилизированные солевыми связями, водородными связями и гидрофобными взаимодействиями. Роль аминокислот с алифатическими неполярными группами сводится к образованию гидрофобных зон и гидрофобных «карманов» в молекулах белков. Слабые гидрофобные взаимодействия между алифатическими группами позволяют белковым молекулам с минимальным изменением энергии перестраивать третичные структуры в ответ на связывание функциональных групп на поверхности белковой молекулы с соответствующими субстратами или на изменение рН среды. Такие структурные перестройки лежат в основе функционирования рецепторных участков сенсорных клеток, транспортных белков, ферментов и вообще всех проявлений роли белков в живой природе. Аминокислоты аланин (R = CH3), валин (R = (CH3)2CH), лейцин (R = (CH3)2CHCH2) и изолейцин (R = C2H5CH(CH3)CH)
могут быть использованы организмом в качестве источника энергии, но в первую очередь – это основной материал для построения белков мышечной ткани. Остаток R метионина (R = СH3SCH2CH2 ) также может исполнять роль гидрофобного фрагмента. Так, например, есть две различающиеся только одной аминокислотой молекулы нейропептида энкефалина (пентапептид, участвующий в работе ЦНС) – Мет–энкефалин (Тир–Гли–Гли–Фен–Мет) и Лей–энкефалин (Тир–Гли–Гли–Фен–Лей), из чего следует, что остатки R метионина и лейцина при всем их химическом различии в этом случае играют всего лишь роль гидрофобного фрагмента. Кроме того, метионин входит в состав многих белков с каталитическими функциями. В частности, он служит донором метильных групп при биохимическом метилировании, например, аминогрупп. При этом промежуточным продуктом является S‑аденозилметионин с сульфониевой группой:
При взаимодействии с нуклеофильной молекулой S-аденозилметионин деметилируется и разлагается на аденозин и гомоцистеин (небелковая аминокислота, гомолог цистеина). В растениях S-аденозилметионин превращается в циклопропанаминокарбоновую кислоту, которая служит источником этилена, регулирующего процесс созревания плодов и листопада. Метилирование метионина по атому серы приводит к сульфониевому соединению:
которое может быть использовано в лечении язвы желудка (его даже называют витамин U от латинского названия язвы – ulcer). В общем случае метионин – это источник сернистых соединений для организма. Очень мало этой аминокислоты в белках сои, поэтому при составлении комбикормов на основе сои добавляют метионин. Метионин – это единственная аминокислота, для которой существует многотоннажное синтетическое производство. Кстати, у метионина нет необходимости в выделении L ‑изомера, поскольку его D -изомер нетоксичен. Триптофан также может выполнять роль аминокислоты с гидрофобным остатком, но его роль в живой природе далеко выходит за эти рамки. Индольная гетероциклическая система триптофана представляет собой донор электронов для образования комплексов с переносом заряда:
Кроме того, из триптофана образуется переносчик сигналов в ЦНС (нейромедиатор) серотонин и регулирующий сон гормон мелатонин. Экзогенный триптофан можно было бы использовать в качестве пищевой добавки со свойствами успокаивающего средства (транквилизатора), которое из-за его естественного характера, конечно, было бы безопаснее синтетических препаратов. На рынке лекарственных средств триптофан вытеснял обычные транквилизаторы, и фармацевтические фирмы развернули против него широкую кампанию, собрав статистику сомнительного характера о повышенной частоте заболеваний крови у тех, кто употреблял его. Тем не менее на основании этих данных американское Управление по контролю за пищевыми продуктами и лекарственными препаратами (Food and Drug Administration – FDA) запретила использование триптофана в качестве пищевой добавки, и этот запрет действует до сих пор, хотя позже было установлено, что выявленные противопоказания были связаны с употреблением триптофана, произведенного по упрощенной технологии одной японской компанией.
Ароматический цикл фенилаланина (R = С6Н5СН2) также поставляет p‑электроны для образования комплексов с переносом заряда, но в этом он уступает триптофану. Важно, что фенилаланин – это предшественник практически всех биогенных веществ с бензольным циклом. В растениях эта аминокислота служит источником многих окрашенных веществ – антоцианов, флаваноидов. Кроме того, из фенилаланина в клетках растений образуется лигнин – важная составляющая древесины. У животных из фенилаланина через тирозин образуются такие регуляторные вещества, как адреналин и дофамин, гормоны щитовидной железы и другие вещества, например, меланин, окрашивающий кожу и волосы. В состав многих пептидов с регуляторной и нейромедиаторной активностью входит аминокислота тирозин
Тирозин образуется при ферментативном окислении фенилаланина, поэтому все, что было сказано выше о фенилаланине, относится и к тирозину. Амидные группы аспарагина ( R = H2NCOCH2) и глютамина (R = H2NCOCH2CH2 ) играют важную роль в образовании водородных связей в белковых молекулах. Кроме того, амидная группа свободного (то есть не включенного в белковую молекулу глютамина) участвует в детоксикации аммиака, образующегося при дезаминировании аминокислот. Очень важна гидроксильная группа серина ( R = CH2OH ). В ферментах с гидролазной активностью она находится в каталитическом центре и принимает на себя ацильный остаток гидролизуемого амида или сложного эфира, а сам серин – это исходный продукт для образования глицина, который не только участвует в образовании белков, но и выполняет функцию нейромедиатора торможения в нейронах спинного мозга. Участие в каталитических процессах гидроксильной группы треонина (R = СН3CHOH ), входящего в состав белковой молекулы фермента, пока не подтверждено, поэтому ее роль, очевидно, заключается только в образовании водородных связей и в гидрофилизации белка.
Аспарагиновая (R = HOOCCH2)и глютаминовая (R = HOOCCH2CH2) кислоты имеют карбоксильные группы, которые не участвуют в образовании пептидных связей. Эти карбоксильные группы предоставляют белкам возможность образования солей с основными группами других фрагментов аминокислот, а также для связывания с основными группами субстратов в активных центрах ферментов. g-Карбоксильная группа глютаминовой кислоты участвует в детоксикации эндогенного аммиака, превращаясь в амидную (глютаминовая кислота превращается в глютамин), кроме того, аминная функция глютаминовой кислоты также включена в процесс обмена аммиака через кетоглутаровую кислоту. Кроме того, глютаминовая кислота – это исходный продукт для образования g-аминомасляной кислоты, выступающей в роли нейромедиатора торможения, а сама глютаминовая кислота – это нейромедиатор возбуждения в ЦНС: до 70% контактов между нейронами ЦНС обеспечиваются этой аминокислотой. Глютаминовая и аспарагиновая кислоты при дезаминировании превращаются в кетоглутаровую и, соответственно, щавелевоуксусную кислоту, которые являются промежуточными продуктами в циклическом превращении лимонной кислоты (цикл Кребса), обеспечивающем энергетику аэробных клеток. В составе белков аргинин предоставляет для образования солевых связей сильное органическое основание – гуанидиновую группу:
В свободном виде аргинин участвует в циклическом процессе, предназначенном для перевода образующегося в метаболических превращениях аминокислот токсичного аммиака в нетоксичную мочевину. Кроме того, гуанидиновая группа аргинина является единственным эндогенным источником монооксида азота. Исследования последних лет (в 1992 г. монооксиду азота присвоено звание Молекулы года) показали, что монооксид азота участвует в регуляции тонуса кровеносных сосудов (лекарства на основе нитроглицерина и других нитратов). Отмечен положительный эффект диеты с повышенным содержанием аргинина на иммунитет и на состав липопротеинов крови, которые переносят холестерин. Диета для снижения веса также должна содержать повышенные количества аргинина, иначе уменьшение объема жировой ткани будет сопровождаться деградацией мышечной ткани. В образовании солевых связей в белках участвует еще одна аминокислота – лизин (R = H2NCH2CH2СH2СH2), но в некоторых ферментах ее аминогруппа служит для присоединения простетических групп, выполняющих каталитическую функцию. В качестве пищевой добавки лизин используется для профилактики остеопороза и катаракты. Диета с повышенным содержанием лизина позволяет преодолеть отрицательные воздействия стресса на мышечную ткань, а добавки лизина в количестве 1–3 г в день значительно облегчают течение герпесных инфекций. Лизин, как и метионин, производится в промышленном масштабе для введения в состав комбикормов (очень мало этой аминокислоты в составе белка зерен пшеницы глиадина), но получают его микробиологическим путем.
Аминокислота с самой слабой основной группой – гистидин – играет важную роль в функционировании ферментов. С участием имидазольного фрагмента гистидина идет перенос протонов, например, по схеме
Гистидин относится к незаменимым аминокислотам, однако обычно недостаток в этой аминокислоте не ощущается, в полноценной белковой пище ее вполне достаточно. К аминокислотам, которые выполняют особую роль в организации структуры белков, можно отнести глицин, пролин и цистеин:
У глицина отсутствует боковой радикал (R = H), и поэтому в белках он обычно играет роль вставки между аминокислотами с объемными радикалами. Что касается пролина, то его пятичленный пирролидиновый цикл имеет углы связей, отличающиеся от углов в молекулах с ациклическими sp 3-гибридизованными атомами углерода. Поэтому остаток пролина в молекуле белка всегда находится в точке изгиба, поворота в ее вторичной структуре. Очень важна в организации третичной структуры белка роль цистеина. Тиольные группы двух фрагментов этой аминокислоты в составе белка легко окисляются с образованием дисульфидных связей (две молекулы цистеина, соединенные дисульфидной связью – это аминокислота цистин). Дисульфидные связи образуют поперечные сшивки между далеко отстоящими друг от друга фрагментами цистеина в пептидной цепи, фиксирующие ее в определенном положении. Этот эффект проще всего демонстрируется на химической завивке волос. Обработка белка волос кератина восстановителем (тиогликолевая кислота) приводит к разрыву дисульфидных связей, что позволяет белковым молекулам скользить относительно друг друга. Затем действие окислителя восстанавливает дисульфидные связи, но после смещения молекул эти мостики возникают уже в других точках, фиксируя новое положение этих молекул, то есть такая завивка обеспечивается новым положением химических связей. Очень важна лекарственная роль цистеина. N-Ацетилцистеин используется в качестве средства от кашля (препарат АСС), цистеином лечат колиты и потерю волос у женщин. В основе андрогенного облысения лежат мужские гормоны, а у женщин потеря волос чаще всего связана с недостатком серы в пище (диеты!). Однако гораздо важнее участие цистеина в образовании трипептида глютатиона (γ-Глу–Цис–Гли) – регулятора окислительно-восстановительных процессов, антиоксиданта и нейтрализатора попадающих в организм алкилаторов (здесь используется высокая нуклеофильность атома серы в тиольной группе). Недостаток глютатиона в организме приводит к возникновению злокачественных опухолей, к обострению сердечно-сосудистых заболеваний, диабету и артритам. Есть данные о применении глютатиона в терапии ВИЧ-инфекций. Очень важно, что N‑ацетилцистеин повышает уровень глютатиона больше, чем прием более дорогого глютатиона. Одно из современных средств для лечения злокачественных новообразований – реканкостат – представляет собой композицию из цистеина, глютатиона и антоциановых красителей (черника). Цистеин является также исходным продуктом для образования небелковой аминокислоты таурина (Н2NCH2CH2SO3H), который регулирует транспорт субстратов через клеточные мембраны. Недостаток таурина вызывает болезни сердца, судорожные припадки и нарушения зрения. Кроме приведенных двадцати аминокислот белки могут также содержать и некоторые другие аминокислоты. Так, например, в состав белка соединительной ткани коллагена входят 5-гидроксилизин и 4‑гидроксипролин (в их образовании из лизина и пролина участвует аскорбиновая кислота). Одним из факторов свертывания крови является гликропротеин протромбин, содержащий g‑карбоксиглютаминовую кислоту. Необычные аминокислоты могут входить в состав пептидов: антибиотик – циклический декапептид грамицидин С (S) – включает две молекулы орнитина (эта аминокислота образуется при гидролитическом отщеплении мочевины от аргинина) и две молекулы D -фенилаланина. В составе многих антибиотиков есть a‑аминоизомасляная кислота. В состав витамина фолиевой кислоты входит 4‑аминобензойная кислота, а другой витамин – пантотеновая кислота – содержит b‑аланин (H2NCH2CH2COOH). Многие небелковые аминокислоты (их известно около 300) токсичны. Чаще всего их токсичность основана на подобии их структур структурам белковых аминокислот. Системы биосинтеза встраивают их в пептидную цепь вместо соответствующих белковых аминокислот, что приводит к образованию аномальных белков. Таковы, например, пары азетидин-2-карбоновая кислота и пролин, цианаланин и серин:
В организме человека отсутствуют биохимические системы, синтезирующие аргинин, гистидин, валин, лейцин, изолейцин, лизин, метионин, фенилаланин, треонин, триптофан. Эти аминокислоты обязательно должны поступать с пищей и их называют незаменимыми, то есть их недостаток не может покрываться другими белковыми аминокислотами. При поступлении в организм достаточного количества фенилаланина он может превращаться в тирозин и покрывать потребность и в этой аминокислоте, а цистеин можно относить к заменимым аминокислотам только в том случае, когда пища содержит избыточное количество метионина. С учетом этого условия к заменимым аминокислотам относятся аланин, аспарагиновая кислота, аспарагин, глютаминовая кислота, глютамин, цистеин, глицин, пролин, серин и тирозин, которые могут образовываться в организме человека из других (незаменимых) аминокислот или из других продуктов метаболических превращений. Недостаток аминокислот в пище и дефицит даже по одной незаменимой аминокислоте приводит к снижению уровня белков в крови, что сопровождается замедлением образования белков в организме. Интересно, что при этом перестают вырабатываться и пищеварительные ферменты (они ведь тоже имеют белковую природу) и тогда нарушается течение пищеварительных процессов, то есть недостаток аминокислот приводит к сокращению их поступления даже в тех случаях, когда они есть в пище, но в неполноценном составе или в дефиците. Недостаток цистеина, особенно на фоне алкогольной интоксикации, вызывает некроз печени, при недостаточном поступлении гистидина и триптофана развивается катаракта, а дефицит по лизину и метионину приводит к анемии. Отечные явления наблюдаются при недостатке треонина (человек «пухнет» от голода). При исключении белков из рациона организм человека начинает терять до 25 г аминокислот в день. Это означает, что замена белковых компонент организма новыми (разбор белков на запчасти) идет так, что остаются «лишние» детали. Дефицитной по отдельным аминокислотам может быть пища растительного происхождения (вегетерианская диета), тогда как белки животного происхождения обычно покрывают потребность в незаменимых аминокислотах, хотя в отдельных случаях, как отмечалось выше, их поступление в организм должно быть повышено. Если в пище мало даже одной какой-либо незаменимой аминокислоты, то остальные аминокислоты не могут быть ассимилированы в полном объеме и тогда они идут на обеспечение энергетических потребностей или превращаются в жиры. При составлении комбикормов для скота это приводит к непроизводительному расходованию белковой компоненты. Стоит восполнить недостаток в корме несколькими граммами такой дефицитной аминокислоты, как привесы откармливаемого скота заметно возрастают. Что касается питания человека, то здесь следует принимать во внимание, что наиболее чувствительны к дефициту незаменимых аминокислот дети (болезнь квашиоркор – от африканского языка суахили – является следствием недостатка белковой пищи у детей), но для нормального обмена веществ и взрослые должны получать с пищей немного менее 1 г белков с оптимальным составом аминокислот на 1 кг веса тела в день. Более всего близки к оптимальному составу аминокислот белки яиц и молока. В растительной пище и в соединительной ткани животных чаще всего отсутствуют триптофан, лизин и метионин. Так, например, в картофеле понижено содержание триптофана и метионина, и для покрытия дефицита по этим аминокислотам человеку весом около 70 кг приходилось бы съедать 6 кг картофеля в день. Очень богаты белками семена бобовых, но они дефицитны по лизину, а кукуруза содержит сравнительно много лизина и мало триптофана. Комбинирование бобов и кукурузной муки (индейское блюдо суккоташ) позволяет резко сократить общее потребление этих продуктов питания, поскольку аминокислотный состав комбинированной смеси более близок к идеальному, а энергетические потребности покрываются углеводными составляющими продукта. Пептиды и белки В пептидах и белках аминокислоты соединены пептидными связями, которые представляют собой амидные группы, образованные карбоксильными и аминными функциональными группами у асимметрического атома углерода. В соответствии с этим b‑карбоксильная группа аспарагиновой кислоты и g‑карбоксильная группа глютаминовой кислоты, а равно и концевая аминогруппа лизина, в образовании пептидных связей не участвуют. Порядок расположения аминокислот в продукте их поликонденсации с образованием пептидных связей, их последовательность, представляет собой то, что называется первичной структурой белка или пептида
Если пептид содержит не более 20 аминокислот, то его обычно называют олигопептидом, затем идут полипептиды, а от 100 аминокислот начинаются белки. Правда, по некоторым классификациям считается, что полипептиды заканчиваются на 50 аминокислотных компонентах, при этом полагается, что промежуток между ними и белками не заслуживает внимания. В составе белка или пептида аминокислота со свободной a-аминогруппой называется N-концевой аминокислотой, а аминокислота со свободной a-карбоксильной группой – С-концевой аминокислотой. Существуют, конечно, и циклические пептиды, у которых концевые аминокислоты отсутствуют. Первичный порядок пептидов в одно- и трехбуквенном обозначении аминокислот всегда начинается с N‑конца и заканчивается С‑концом. Иногда это подчеркивается тем, что в формуле с трехбуквенным обозначением аминокислот показывают положение аминной и карбоксильной групп, например: Met-Pro-Cys-Gly или H2N-Met-Pro-Cys-Gly-COOH В реальных условиях пространственная организация пептидных и, тем более, белковых молекул не может быть линейной. Важную роль в образовании истинной структуры играют водородные связи, которые устанавливаются между атомами водорода NH-групп и атомами карбонильного кислорода в чередующихся амидных связях. В простейшем случае белковая цепь закручивается в спираль, в которой на один виток приходится 3,6 пептидных фрагментов. Шаг такой спирали равен 0,54 нм, радикалы аминокислот R отходят от спирали, как ветви от ствола дерева. Однако такая пространственная организация, получившая обозначение a‑спирали, не может быть образована пептидной цепью из любых аминокислот. У молекулы пролина, как уже отмечалось выше, иной угол связей у атома углерода несущего аминогруппу и карбоксильную группу, и это небольшое различие оказывается достаточно значимым для того, чтобы нарушить регулярность в чередовании пептидных фрагментов в спирали. На этой аминокислоте a‑спираль всегда заканчивается и переходит в другую вторичную структуру. Не помещаются в спирали и расположенные рядом аминокислоты с объемными заместителями, а аминокислоты с основными и кислотными группами редко оказываются включенными в a‑спирали из-за ионных взаимодействий. Еще одна возможность стабилизации определенной пространственной структуры представлена образованием водородных связей между двумя линейными параллельными или антипараллельными пептидными цепями. Это так называемая складчатая b- структура. В ее состав также могут входить лишь пептидные участки, состоящие из сравнительно простых аминокислот, например аланина, глицина, пролина. В соответствии с принятой классификацией структур белковых молекул a‑спирали, b-структуры и иррегулярные участки представляют собой вторичную структуру белка, а сочетание элементов вторичной структуры в белковой молекуле с участием дисульфидных связей пар цистеиновых фрагментов образуют целостную пространственную третичную структуру белка. Первым белком, на кристалле которого с помощью рентгеноструктурного анализа была установлена третичная структура, стал миоглобин. Его молекула представляет собой комплекс белка и небелковой гемовой молекулы. Биологическая роль миоглобина заключается в транспорте кислорода внутри клетки к митохондриям и в создании запаса кислорода внутри клетки для восполнения его недостатка в критических ситуациях. Гемовые составляющие присутствуют во многих белках с каталитическими и транспортными функциями. Атом железа, находящийся в центре порфириновой гетероциклической системы гема, может связывать молекулу кислорода или же переносить электроны, меняя валентность от +2 до +3 и обратно. В гемоглобинах, предназначенных для переноса кислорода, у атома двухвалентного железа с координационным числом, равным шести, пять координаций заняты атомами азота: четыре – из порфиринового цикла, пятая в перпендикулярном к плоскости молекулы гема направлении занята атомом азота из имидазольного фрагмента гистидина, входящего в пептидную цепочку белковой компоненты гемоглобина. Шестая координация служит для связывания кислорода. Это положение может заниматься и другими молекулами, так, например, монооксид углерода связывается гемом в гемоглобине в 200–250 раз прочнее, чем кислород. Расшифровка структуры миоглобина проводилась в несколько этапов. Миоглобин был получен в виде монокристалла и на рентгенограмме низкого разрешения было сначала установлено пространственное расположение полипептидной цепи без учета отходящих от нее радикалов R. Затем в результате съемки с более высокой разрешающей способностью была получена рентгенограмма, позволившая установить положение тяжелых атомов, входящих в состав этих радикалов. Оказалось, что в миоглобине около 80% всех аминокислотных остатков (всего их 159) включено в восемь почти прямолинейных a-спиралей, из которых самая длинная включает 23 аминокислоты, а самая короткая – 7. Все четыре входящих в состав этого белка молекулы пролина образуют изгиб полипептидной цепи. Все полярные функциональные группы, кроме двух, расположены на наружной поверхности белковой глобулы, а большая часть гидрофобных групп – внутри ее. Молекула миоглобина настолько компактна, что во внутренней сфере могут поместиться всего лишь четыре молекулы воды. Из различных организмов было выделено несколько разновидностей миоглобина, но образуемые ими глобулы очень близки по форме. Оказалось также, что в некоторых ключевых точках полипептидных цепей разных миоглобинов находятся одинаковые аминокислотные последовательности. Такие аминокислоты называют инвариантными. Третичная структура миоглобина, составленная почти исключительно a‑спиралями, определена его ролью переносчика кислорода. Такая жесткая структура мало приспособлена для многообразных конформационных переходов. В соответствии с этим в молекулах ферментов на долю a-спиралей приходится обычно не более 40% аминокислотных составляющих, но именно a-спирали образуют каталитические центры ферментов и предназначенные для связывания с другими молекулами участки рецепторных и регуляторных белков. Миоглобин и еще один белок с гемовой составляющей – цитохром с – не содержат складчатых b-структур, но эти элементы третичной структуры белков обязательны для подавляющего большинства ферментов. В качестве примера можно привести защитный белок с гидролазной активностью лизоцим (от греч. lysis – разрыв, растворение). Он содержится в яичном белке, в слезах и в слюне, а его антимикробная активность основана на расщеплении олигосахаридных фрагментов, соединенных со структурными элементами мембран многих бактерий. В b‑структуры лизоцима включено 12% аминокислотных фрагментов, в a‑спирали – 40%, а остальные образуют различные изгибы и иррегулярные участки. Активный центр лизоцима составлен только a-спиралями. Еще один фермент рибонуклеаза предназначен для гидролитического расщепления рибонуклеиновых кислот. Рибонуклеаза секретируется клетками поджелудочной железы в двенадцатиперстную кишку и поступает в тонкий кишечник. Молекула рибонуклеазы состоит из 124 аминокислот, из которых 26% входят в состав участков, образующих a-спирали, а 35% находятся в b‑структурах. Нативная конфигурация рибонуклеазы поддерживается четырьмя дисульфидными мостиками. Организация третичной структуры белка происходит в процессе его последовательного биосинтеза из аминокислот, а нарушение нативной структуры нагреванием или высокими значениями рН чаще всего приводит к необратимой потере ферментативной активности. Этот процесс называется денатурацией. Однако многие белки с небольшой молекулярной массой в определенных условиях могут подвергаться обратимой денатурации. К таким белкам относится и рибонуклеаза. При обработке рибонуклеазы концентрированным раствором мочевины (разрыв водородных связей между пептидными функциональными группами) и меркаптоэтанолом (разрыв дисульфидных связей) белковая цепь рибонуклеазы разворачивается и теряет каталитическую активность, поскольку в этом случае пространственная организация активного центра оказывается полностью нарушенной. Если денатурированную таким мягким способом рибонуклеазу подвергнуть диализу, то есть с помощью полупроницаемой мембраны отмыть от нее мочевину и избыток меркаптоэтанола, то она почти полностью (на 95%) восстановит каталитическую активность, а через некоторое время в процессе окисления кислородом воздуха восстановятся дисульфидные мостики и структура белка стабилизируется. После этого рибонуклеаза станет гораздо более устойчивой к внешним воздействиям, чем без этих жестких сшивок, поддерживающих оптимальную третичную структуру. Интересно, что простой вероятностный перебор вариантов самоорганизации белка из 100 пептидных фрагментов для получения конфигурации с минимумом энергии занял бы 1050 лет. Очевидно, правильная укладка небольшого участка полипептидной цепи значительно упрощает организацию расположенных рядом участков, и чем больший участок белковой молекулы принял оптимальную структуру, тем скорее в этот процесс вовлекаются остальные участки. Простота такой самоорганизации денатурированного щадящими способами белка может быть связана и с тем, что в нем сохраняются определенные критические структурные элементы, вокруг которых затем и идет ренатурация. В связи с этим понятно, что расшифровка генетического кода пока не может быть эффективно использована для получения белков с правильной третичной структурой. Здесь можно вспомнить, что ДНК кроме значащих участков содержит так называемые интроны, вычленить которые на основании формальных признаков без ошибок не так просто. Если это все же удастся, то самопроизвольное сворачивание синтезированной в соответствии с кодонами ДНК белковой молекулы в требуемую для правильного функционирования белка пространственную структуру (фолдинг) еще менее вероятно. По строению белки разделяются на две основные группы – фибриллярные (нитевидные) и глобулярные (овальной или округлой формы). По биологической функции можно выделить следующие группы белков: · ферменты; · транспортные белки (гемоглобин, сывороточный альбумин, липопротеины); · пищевые или запасные белки (глиадин из зерен пшеницы, яичный альбумин, казеин); · сократительные и двигательные белки (актин, миозин, тубулин); · структурные белки (коллаген, эластин, кератин, фиброин); · защитные белки (антитела, тромбин, токсины, например, токсин ботулизма, рицин, яды змей и паукообразных); · регуляторные белки (инсулин, кортикотропин, репрессоры и др.). Белковые молекулы в биологических объектах всегда находятся в состоянии сборки и разборки, что объясняет присутствие в клетках как свободных аминокислот, так и очень большого числа пептидных молекул различного размера в разных концентрациях. Так, например, в клетках можно с помощью экстракции и хроматографии обнаружить около 100 пептидов с концентрацией, превышающей 100 пмоль/г, с концентрацией от 10 до 100 пмоль/г их уже около 1000 и еще на порядок возрастает число пептидов, содержание которых не превышает 1 пмоль/г. Понятно, что состав пептидов в значительной мере зависит от способов их выделения. Многие аминокислоты выполняют определенные метаболические и регуляторные функции, и поэтому их роль не ограничивается только участием в биосинтезе белков в качестве их структурных элементов. Постоянно расширяются знания о регуляторной роли пептидов. Многие из них играют роль гормонов. Сравнительно простое соединение – глютатион, представляющий собой ацилированный g-карбоксильной группой глютаминовой кислоты цистеинилглицин, защищает все живые клетки от алкилаторов, окислителей и свободных радикалов. Пентапептид энкефалин Тир–Гли–Гли–Фен–Мет выполняет функцию нейромедиатора в нервной системе человека, то есть это вещество участвует в межнейрональных взаимодействиях. Из мозга быка выделен дипептид киоторфин с аналогичной ролью (Тир–Арг), а у насекомых нейромедиатором является пентапептид проктолин Арг–Тир–Лей–Про–Тре. Проявляют биологическую активность и некоторые пептиды, образующиеся при неполном ферментативном гидролизе белков и полипептидов. Так, например, сравнительно устойчивы к действию пищеварительных ферментов продукты протеолиза казеина b-казоморфины Тир–Про–Фен–Про–Гли–Про–Иле (из молока коровы) или Тир–Про–Фен–Вал–Глу–Про–Иле (из материнского молока). Эти вещества могут поступать в кровь из пищеваритель
|
||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 147; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.66.178 (0.061 с.) |