Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Модульный урок по химии в 9 классеСтр 1 из 3Следующая ⇒
Модульный урок по химии в 9 классе По теме «Простые вещества – неметаллы»
учебный элемент; Учебный материал с указанием заданий Руководство по усвоению учебного материала УЭ -0
Интегрирующая дидактическая цель модуля: 1. рассмотреть положение неметаллов в системе элементов Д.И. Менделеева; 2. познакомить с основными физическими свойствами неметаллов, выяснить, чем они обусловлены; 3. выяснить, чем атомы неметаллов отличаются от атомов металлов; 4. познакомиться с получением и применением неметаллов; 5. развить учебные навыки работы с текстом, с химическими веществами и оборудованием; развить творческие способности школьников и желание продолжить самостоятельную работу; формировать универсальные учебные действия: наблюдать, сравнивать, рассуждать, анализировать, обобщать и делать выводы. 6. обучать учащихся самостоятельности при получении знаний; выработке собственного мнения; умения работать в парах, быть внимательным к себе и к окружающим. 7. профилактика умственного перенапряжения путем смены видов деятельности. 8. УЭ -1 Оргмомент.
Добрый день, мои юные исследователи! Я рада видеть ваши умные и любознательные лица! Сегодня у нас с вами не совсем обычная работа и я немного волнуюсь: всё ли из задуманного мы сможем осуществить. Поэтому мы должны работать слаженно, как единый организм. Итак, начинаем… Послушайте притчу: «Один начинающий волшебник, герой шуточной песенки, неумело обращался с заклинаниями, в результате вместо грозы у него получилась коза, а вместо утюга – слон». Умение правильно видеть и слышать - первый шаг к мудрости. Хочется, чтобы сегодня вы показали, насколько вы мудры. Я думаю, что никому не хочется оказаться на месте волшебника. Определение темы и целей урока: Вы, наверное, уже обратили внимание, что на столах присутствует коллекция веществ.
- Посмотрите на коллекцию и определите – что это? (Неметаллы)
- Почему вы так решили? (перечисляют физические свойства) - Какую же тему мы сегодня начнем изучать? Правильно, сегодня мы с вами будем говорить о неметаллах. - А зачем нужно и важно изучать неметаллы? - Что называется неметаллом? - А что вы уже знаете о неметаллах из курса 8 класса?
- Зачем же мы опять изучаем неметаллы? (углубление и расширение знаний).
Обратите внимание на цель нашего урока. - Какие вопросы мы должны сегодня рассмотреть? Запишите число и тему урока «Простые вещества – неметаллы». Это первый урок по неметаллам.
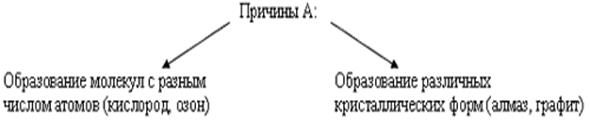
Номенклатура для подготовки к ГИА: неметаллы, химическая связь, ковалентная связь, окислитель, восстановитель, группа, период, физические свойства, простые вещества, Откройте словари Даля или Ожегова, найдите определение «неметаллы». УЭ- 2 Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
Внимание! Проблема! Объясните, чем отличаются атомы неметаллов от атомов металлов. (Атомы металлов имеют большой радиус - атомы неметаллов имеют малый радиус. Атомы металлов имеют мало электронов на внешнем уровне - атомы неметаллов имеют много электронов на внешнем уровне. Атомы металлов легко отдают электроны с внешнего уровня - атомы неметаллов легко принимают недостающие электроны на внешний уровень. Металлы - хорошие восстановители. Неметаллы - хорошие окислители). Проверка!
Физминутка - А теперь пришло время поиграть. Встаньте ровно. Выпрямите спины. Внимательно смотрите на экран. На нем будут появляться знаки химических элементов. Если знак на экране – металл, вы должны поднять руки вверх и хлопнуть в ладоши. Если на экране – неметалл, вы должны потопать ногами. Внимание на экран! Самоконтроль. Уровень 1. 1. У какого элемента IV группы главной подгруппы углерода или азота ярче выражены неметаллические свойства. 2. Простое вещество – неметалл у элемента: 1) Au 2) Mg 3) C 4) Ag Уровень 2. 1. Электронная формула 1s22s22p63s2p3 1) Fe 2) N 3) P 4) Cr. 2. Наибольшими неметаллическими свойствами обладает атом с электронной формулой: 1) 1s22s22p6 3s2p2 2) 1s22s22p63s2p4 3) 1s22s22p63s2p3 4) 1s22s22p63s2p5 3. Наиболее электроотрицательный неметалл 1) S 2) H 3) F 4) O Уровень 3 1. В каком ряду ослабевают неметаллические свойства. 1) S – P – Si 2) O – S – Se 3) B - C – N 4) Si – P - S
2. Из предложенного перечня веществ определите атомы каких элементов имеют на внешнем ЭУ 4 электрона: натрий, калий, кремний, магний, углерод. 3. Длина ковалентной связи наибольшая: 1. H2Te 2) H2O 3) H2Se 4) H2S
Работа в рабочих листах.
Взаимопроверка, смотрите ответы на экране.
Откройте ПСХЭМ (форзац учебника)
Работа в рабочих листах.
Работа с текстом, заполнение схемы
УЭ- 3 Изучение свойств металлов.
Цель: познакомить с основными физическими свойствами неметаллов, выяснить, чем они обусловлены; 1. Твердость – Агрегатное состояние: o газообразное(H2, O2, Cl2,F2, O3) o твердое (Р, С) o жидкое (Br2) 2. - Пластичность, ковкость – это свойство металлов изменять свою форму при ударе. - Ковкость у неметаллов отсутствует 3. - Металлический блеск – все металлы обладают металлическим блеском. - Блеска у неметаллов нет 4. - Тепло- и электропроводность – металлы, характеризующиеся высокой электрической проводимостью, обладают и высокой теплопроводностью. - Из неметаллов лишь некоторые обладают электропроводимостью (только графит и черный Фосфор.) и теплопроводимостью(графит) 5. Цвет разнообразный: желтый, желтовато-зеленый, красно-бурый. УЭ – 4 Лабораторная работа. Цель: изучить способ получения кислорода и водорода в лаборатории, выяснить как можно обнаружить эти газы. Оборудование: штатив большой, изогнутая стеклянная трубка с пробкой, кусочек ваты, лучинка,, спиртовка, спички, стакан с водой. Реактивы:, KMnO4 –соль кристаллическая, соляная кислота, цинк, пероксид водорода, оксид марганца(IV) Опыт1. Получение водорода. Порядок действий: в пробирку поместите 1–2 гранулы цинка, прилейте около 3 мл раствора соляной кислоты; накройте пробирку воронкой широкой частью вниз, на носик воронки наденьте чистую пробирку. Подожгите спиртовку. Поднесите пробирку с полученным водородом к пламени спиртовки для обнаружения водорода. Запишите уравнение реакции получения водорода и наблюдения в тетрадь: Zn + HCl = …………………………. Наблюдения: 1) при взаимодействии цинка с соляной кислотой (HCl)появились пузырьки газа это ………………………. 2)при поднесении пробирки с водородом к спиртовке появился свистящий звук следовательно там был …… (какой чистый или не чистый водород) ……………………, если звук «п-х-х» …………… (какой чистый или не чистый водород) ……………, 3) водород … (какой легче или тяжелее воздуха) ………………………………, поэтому его собираем в перевёрнутую пробирку.
Работа с текстом, составление опорного конспекта.
Проведите лабораторный опыт, составьте уравнения реакций, выводы запишите в тетради
УЭ – 5 Применение неметаллов Цель: рассмотреть основные области применения неметаллов. Поскольку свойства неметаллов чрезвычайно разнообразны, эти вещества находят широкое применение в различных отраслях народного хозяйства.
Таблица. Применение неметаллов.
Такие неметаллы, как сера S, азот N2, фосфор P и хлор Cl2 используются в качестве сырья для получения кислот и другой продукции. Сера S используется в качестве сырья в производстве резин. Сажа C служит пигментом в производстве лаков и красок, а также пигментом и наполнителем в производстве пластмасс и резин.
Транспорт Водород H2 используется в качестве топлива.Важно, что продукт сгорания этого топлива не загрязняет среду. Сельское хозяйство Сера S используется как эффективное средство борьбы с вредителями и болезнями растений. Медицина Кислород O2 применяют в тех случаях, когда у больного затруднено дыхание. Активированный уголь C есть почти в каждой домашней аптечке. Точно так же, как иодная тинктура — спиртовой раствор иода I2.Мази, в состав которых входит сера S, используются при лечении кожных заболеваний. Жидкий азот N2 используют не только для хранения биологического материала, но и в косметической медицине. Подготовка воды Для дезинфекции воды используют хлор Cl2 и озон O3. Получение высоких температур В металлургии и металлообработке для того, чтобы, сжигая горючее вещество, создать среду с высокой температурой, используют кислород O2. Пиротехника В производстве спичек и другой пиротехнической продукции используют серу S, фосфор P и уголь C. Пищевая промышленность Для продления срока годности пищевых продуктов и для создания инертной атмосферы в упаковку закачивается азот N2.
1) Вставьте слова, пропущенные в тексте. 2) Вставьте слова, пропущенные в тексте. 3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер? 4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента? 5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F. 6) Какую высшую степень окисления имеют следующие элементы? 7) Определите, окислителем или восстановителем является сера в следующих реакциях: H2+S=H2S 2SO2 + O2 → 2SO3 8) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно____. • 4 • 5 • 6 • 7 9) Наиболее электроотрицательными являются атомы • серы • фосфора • кремния • хлора 10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям:
· 2, 1 · 2, 8, 2 · 2, 8, 7 Поменяйтесь тестом с соседом и проверьте тест вместе со мной. УЭ – 7 Контроль 1) Вставьте слова, пропущенные в тексте. 2) Вставьте слова, пропущенные в тексте. 3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер? 4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента? 5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F. 6) Какую высшую степень окисления имеют следующие элементы? 7) Определите, окислителем или восстановителем является сера в следующих реакциях: H2+S=H2S 2SO2 + O2 → 2SO3 8) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно____. • 4 • 5 • 6 • 7 9) Наиболее электроотрицательными являются атомы • серы • фосфора • кремния • хлора 10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям: · 2, 1 · 2, 8, 2 · 2, 8, 7 Задачи. 1. Вычислите объем воздуха, который потребуется для сжигания 20 м3 сероводорода, если продуктами реакции являются вода и оксид серы (IV). Вычислите массу этого воздуха. Дано: Решение V(Н2S) = 20м3 20 м3 х м3 Найти: V(воздуха) 2Н2S + 3O2 = SO2 + H2O m(воздуха) 2 моль 3 моль V(О2) = 20·3/2 = 30 м3 т.к в воздухе всего 32% О2, то V(воздуха) = 30·100/21 = 142, 86 м3 m(воздуха) = V/Vm·M = 142,86/22,4·29 = 184,29 г Ответ: для сжигания 20 м3сероводорода потребуется 142,86 м3 воздуха, m(воздуха) = 184,29 г
2. Определите состав смеси азота и водорода, имеющий плотность по водороду 4,25. Дано: Решение DH2 = 4,25 Пусть Vсмеси = 22,4 л (n = 1 моль) Найти: φ(N2) n (N2) = х, n (Н2) = у, тогда φ(H2) m(N2) = 28х, г m(Н2) = 2у г, m(Н2) = 22,4· 2/22,4 = 2 г → DH2 = (28х + 2у)/2 = 4,25. х + у = 1 (28х + 2у)/2 = 4,25 х = 0,25 у = 0,75 φ(N2) = 0,25/ 1 = 0,25 или 25% φ(H2) = 0,75/1 = 0,75 или 75% Ответ: состав смеси азота и водорода 25% и 75%
3. Вычислите объём водорода, который потребуется для восстановления 928 кг оксида вольфрама(VI), содержащего 25% примесей. Дано: Решение m(WO3) = 928 кг W(WO3) = 100-25=75%, W(прим) = 25% m(WO3)чист = 928·75%/100%=696 кг. Найти: V(Н2) WO3 + 3H2 = W + 3H2O 232 184 По реакции составляем пропорцию: 232 г WO3 восст-ся 3 х 22,4 л=67,2 л Н2 696000 г WO3 восстанавливаются Х л Н2. Находим Х: Х=67,2 л * 696000 г/232 г =201600 л = 201,6 м3 Составляем вторую пропорцию для нахождения массы образовавшегося металла: 232 г WO3 образуется 184 г W 696000 г WO3 образуется Y г W Находим Y: Y=184 г * 696000 г/232 г = 552000 г = 552 кг Ответ: Для восстановления 928 кг оксида вольфрама (VI), содержащего 25% примесей, необходимо 201600 л (201,6 м3) водорода. При этом образуется 552000 г (552 кг) металла.
4. Для синтеза хлороводорода взяли 200 л водорода и 250 л хлора. Какие газы и в каком объеме останутся в сосуде после реакции? Дано: Решение V(Н2) = 200л H2+Cl2=2HCl V(Cl2) = 250л n(Cl2)=200:22.4=8.9моль Найти: V(газов) соотношение 1:1,значит H2 в избытке 11.1-8.9=2.2мольH2 избыток n(Cl2)=2n(HCl)=8.9*2=17.8 моль Ответ: в сосуде после реакции останется водород в объёме 49,28 л. 5. Французский химик К. Шееле получил хлор по реакции оксида марганца (IV) с соляной кислотой. В результате этой реакции образуется так же хлорид марганца(II) и вода. Составьте уравнение реакции, рассчитайте массу оксида марганца(IV) и количество хлороводорода, необходимых для получения 100 л хлора, если выход составляет 95% от теоретически возможного. Дано: Решение η= 95% х,г 105,26 n(Cl2) = 100л MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O Найти: m(MnO2) 1моль 1моль m(HCl) 87г/моль 22,4л/моль Vтеор = V(Cl2)/η= 100/ 0.95 = 105.26 л n(НCl) = 4·n(Cl2) = 4·105,26/22,4 = 18,8 Из 87 г MnO2 образуется 22.4 л Cl2 Из х г MnO2 образуется 105,26 л Cl2 Х = 408,82 г
Ответ: масса оксида марганца(IV) необходимых для получения 100 л хлора равна 408,82 г. Количество хлороводорода, необходимых для получения 100 л хлора равно18.8 моль УЭ -0 Интегрирующая дидактическая цель модуля: 1. рассмотреть положение неметаллов в системе элементов Д.И. Менделеева; познакомить с основными физическими свойствами неметаллов, выяснить, чем они обусловлены; 2. выяснить, чем атомы неметаллов отличаются от атомов металлов; 3. познакомиться с получением и применением неметаллов; 4. развить учебные навыки работы с текстом, с химическими веществами и оборудованием; 5. обучать учащихся самостоятельности при получении знаний; выработке собственного мнения; умения работать в парах, быть внимательным к себе и к окружающим.профилактика умственного перенапряжения путем смены видов деятельности.
УЭ -1 - Какие вопросы мы должны сегодня рассмотреть? Задание: Запишите число и тему урока «Простые вещества – неметаллы». Это первый урок по неметаллам.
УЭ- 2 УЭ- 3 Сравнение физических свойств металлов и неметаллов. Цель: познакомить с основными физическими свойствами неметаллов, выяснить, чем они обусловлены; В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств.
Задание. Пользуясь учебником, заполни таблицу.
- Чем определяются физические свойства неметаллов? - Во что превратятся атомы неметаллов, отдавшие или принявшие электроны? - Чем являются неметаллы: окислителями или восстановителями?
УЭ – 4 Опыт1. Получение водорода. Порядок действий: в пробирку поместите 1–2 гранулы цинка, прилейте около 3 мл раствора соляной кислоты; накройте пробирку воронкой широкой частью вниз, на носик воронки наденьте чистую пробирку. Подожгите спиртовку. Поднесите пробирку с полученным водородом к пламени спиртовки для обнаружения водорода. Запишите уравнение реакции получения водорода и наблюдения в тетрадь: Zn + HCl = …………………………. Наблюдения: 1) при взаимодействии цинка с соляной кислотой (HCl)появились пузырьки газа это ………………………. 2)при поднесении пробирки с водородом к спиртовке появился свистящий звук следовательно там был …… (какой чистый или не чистый водород) ……………………, если звук «п-х-х» …………… (какой чистый или не чистый водород) ……………, 3) водород … (какой легче или тяжелее воздуха) ………………………………, поэтому его собираем в перевёрнутую пробирку.
УЭ – 5 Применение неметаллов Цель: рассмотреть основные области применения неметаллов. Поскольку свойства неметаллов чрезвычайно разнообразны, эти вещества находят широкое применение в различных отраслях народного хозяйства. Таблица. Применение неметаллов. Пользуясь учебником и доп. материалом запишите опорный конспект.
УЭ – 7 Контроль 1) Вставьте слова, пропущенные в тексте. 2) Вставьте слова, пропущенные в тексте. 3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер? 4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента? 5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F. 6) Какую высшую степень окисления имеют следующие элементы? 7) Определите, окислителем или восстановителем является сера в следующих реакциях: А) H2+S=H2S Б)2SO2 + O2 → 2SO3 8) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно____. • 4 • 5 • 6 • 7 9) Наиболее электроотрицательными являются атомы • серы • фосфора • кремния • хлора 10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям: 2, 1 2, 8, 2 2, 8, 7
Задачи. 6. Вычислите объем воздуха, который потребуется для сжигания 50 м3 сероводорода, если продуктами реакции являются вода и оксид серы (IV). Вычислите массу этого воздуха.
7. Определите состав смеси азота и водорода, имеющий плотность по водороду 4,25.
4. Вычислите объём водорода, который потребуется для восстановления 1000 кг оксида вольфрама(VI), содержащего 25% примесей. 5. Для синтеза хлороводорода взяли 100 л водорода и 150 л хлора. Какие газы и в каком объеме останутся в сосуде после реакции? 6. Французский химик К. Шееле получил хлор по реакции оксида марганца (IV) с соляной кислотой. В результате этой реакции образуется так же хлорид марганца(II) и вода. Составьте уравнение реакции, рассчитайте массу оксида марганца(IV) и количество хлороводорода, необходимых для получения 100 л хлора, если выход составляет 95% от теоретически возможного.
Поменяйтесь тестом с соседом и проверьте тест вместе со мной
Модульный урок по химии в 9 классе
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 182; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.60.192 (0.139 с.) |