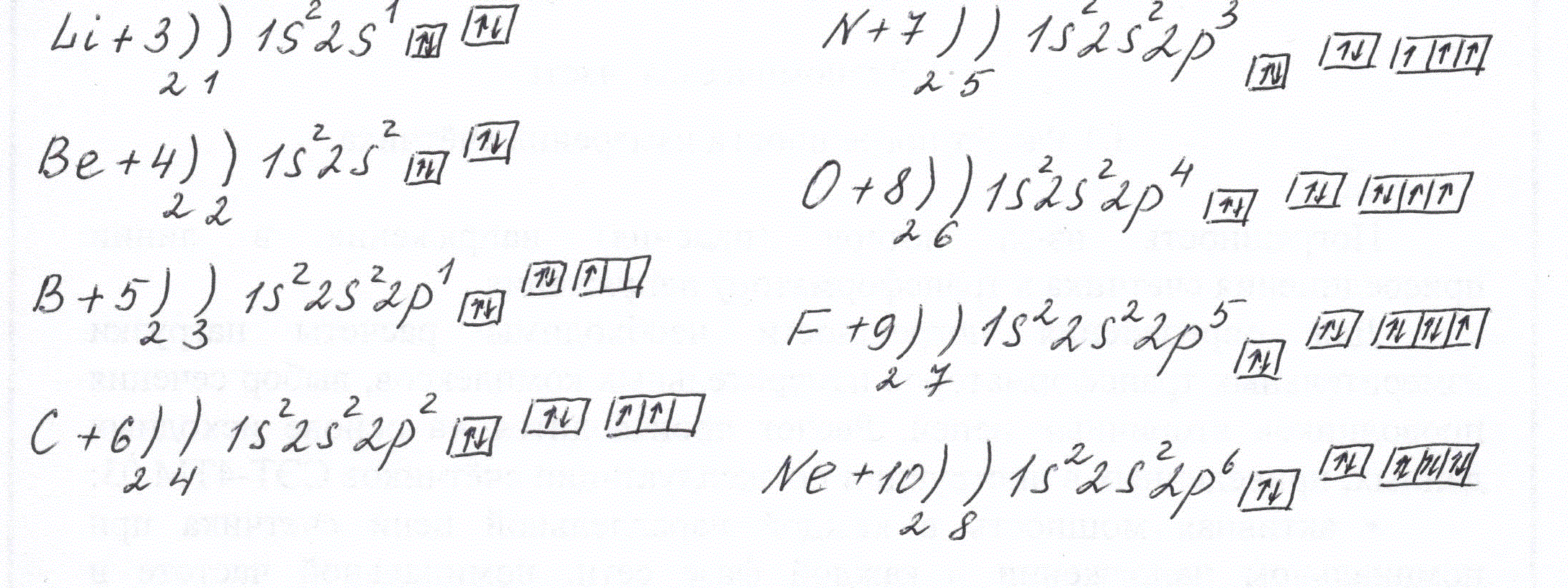Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.Стр 1 из 4Следующая ⇒
Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки. 1 марта 1869 г Д. И. Менделеев сформулировал периодический закон: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов (масс) элементов. В соответствии закону была составлена периодическая система элементов – графическое изображение периодического закона. Периодическая система связана с теорией строения атома Все атомы имеют ядро и электроны. В составе ядра есть протоны и нейтроны. Протон +11 р – частица с массой, равной 1, и зарядом, равным +1 (верхний индекс обозначает массу, нижний - заряд). Нейтрон 01 n – частица с массой, равной 1, но электронейтральная. Электрон -1 0е – частица с зарядом (-1) и массой, приравненной к нулю. Доказано, что, начиная с водорода, все последующие элементы содержат в ядре столько протонов, каков порядковый номер этого элемента. Таким образом, порядковый номер элемента указывает на числовое значение положительного заряда атомного ядра. Масса каждого отдельного атома – это суммарная масса всех протонов и нейтронов ядра (Ar = p + n). Количество нейтронов в атоме рассчитывается по формуле: (n = Ar - p). Физический смысл числовых обозначений в периодической системе химических элементов: - порядковый номер элемента – это положительный заряд ядра атома, число протонов в ядре. Общее число электронов в электронной оболочке атома; - номер периода – это число электронных оболочек в атоме; - номер группы – это число электронов на внешнем слое у элементов главных подгрупп, высшая валентность элементов в соединениях с кислородом, высшая положительная степень окисления элемента в соединениях.
2.Предельные углеводороды, общая формула и химическое строение гомологов данного ряда. Химические свойства алканов на примере метана. Алканы – углеводороды с общей формулой CnH2n+2, в молекулах которых только ординарные связи. Представитель метан СН4. Строение метана и Алканов
Физические свойства Алканов Метан – бесцветный газ, без запаха, легче воздуха, мало растворим в воде. С1 – С4 – газы, С5 – С15 - жидкости, с С16 - твердые вещества. Химические свойства Алканов а) Горение: СН4 + 2О2 → СО2 ↑+ 2Н2О + Q; 2С2Н6 +7О2 →4СО2 ↑+6Н2О+ Q; б) Реакции замещения (на свету): СН4 + Cl2 → СН3Cl + НCl; СН3Cl + Cl2 → СН2Cl2 + НCl; СН2Cl2 + Cl2 → СНCl3 + НCl; в) Реакции разложения при нагревании: СН4 → С + 2Н2 ↑ (t › 1000о С); 2СН4 → С2Н2 +3Н2 ↑ (t = 1500о С); Реакции отщепления молекул водорода – реакции дегидрирования. Применение Алканов а) в качестве топлива; б) в органическом синтезе (хлорпроизводные, альдегиды, органические кислоты); в) путем дегидрирования получают: непредельные углеводороды, водород, сажу.
№2 Современные представления о строении атомов химических элементов. Электронные формулы и графические схемы строения электронных слоев атомов этого периода, изменение их свойств 1. В 20 веке учёным удалось понять сложнейшую структуру атома, строение его электронной оболочки. Работы английского физика Э. Резерфорда, предложившего планетарную модель атома, и исследования датского физика Н. Бора, который связал периодичность свойств элементов с формированием электронных конфигураций атомов, стали основой электронной теории строения атомов. 2. Электронная теория объясняет периодическое изменение свойств элементов. Электроны, составляющие атомную оболочку, распределены по слоям – энергетическим уровням. Электроны имеют разный запас энергии, главным образом в зависимости их удаления от ядра. Строение атомов элементов 2 периода:
В периоде увеличиваются неметаллические свойства элементов в связи с увеличением количества электронов на внешнем слое. Основные понятия химии. Вещество. Атом. Молекула. Химический элемент. Простые и сложные вещества. 1. Атомно – молекулярное учение развил и впервые применил в химии
М. В. Ломоносов (1741г): - Все вещества состоят из корпускул (молекул). - Молекулы состоят из элементов (атомов). - Молекулы и атомы находятся в непрерывном движении. - Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ – из различных атомов. 2. Молекула – это наименьшая частица данного вещества, обладающая его химическими свойствами. 3. Атом – электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. 4. Химический элемент – определённый вид атомов с одинаковым положительным зарядом ядра. 5. Простые вещества – вещества, образованные атомами одного элемента. 6. Сложные вещества – вещества, образованные атомами разных элементов.
Физические свойства Бутадиен - легко сжижаемый газ. Химические свойства 1) реакции присоединения с галогенами: СН2 = СН ― СН = СН2 + Br2 → СН2 Br ― СН = СН ― СН2 Br; 2) реакции полимеризации (образуется бутадиеновый каучук): СН2 = СН − СН = СН2 + СН2 = СН − СН = СН2 +… → (−СН2 − СН = СН − СН2−)n Применение Алкадиены используются для синтеза каучуков (бутадиенового, бутадиенстирольного, хлоропренового, изопренового). №5 Физические свойства Алкинов Ацетилен – бесцветный газ, в чистом виде почти без запаха, легче воздуха, мало растворим в воде. Химические свойства Алкинов: 1) Горит коптящим пламенем: 2С2Н2 + 5О2 → 4СО2 ↑+ 2Н2О; 2) Реакции присоединения: а) с галогенами (галогенирование): СН ≡ СН + Br2 → Br НС = СН Br; б) с водородом (гидрирование): СН ≡ СН + Н2 → Н2С = СН2; в) с водой (гидратация) в присутствии солей ртути (реакция Кучерова): СН ≡ СН + Н2О → СН3СОН; 3) Реакции полимеризации: 3 СН ≡ СН → С6Н6. Получение ацетилена 1) карбидный способ: СаС2 + 2НОН → Са(ОН)2 + С2Н2; 2) разложение метана: 2СН4 → С2Н2 +3Н2 ↑ (t = 1500о С). Применение ацетилена 1) резка и сварка металлов, 2) производство пластмасс (полихлорвинил), 3) получение уксусной кислоты (лекарства, красители, искусственные волокна, духи и одеколоны). №6 Физические свойства Аренов Бензол – бесцветная жидкость с характерным запахом, нерастворимая в воде. Химические свойства Аренов 1) Горит коптящим пламенем: 2С6Н6 + 15О2 → 12СО2 ↑+ 6Н2О; 2) Реакции замещения (свойства Алканов): а) с галогенами: С6Н6 + Br2 → С6Н5Br + НBr; 3) Реакции присоединения (свойства Алкенов): а) с водородом - гидрирование: С6Н6 + 3Н2 → С6Н12; Получение бензола 1) при коксовании каменного угля, 2) при перегонке нефти, 3) из ацетилена: 3 СН ≡ СН → С6Н6 (3С2Н2 → С6Н6); Применение бензола 1) как растворитель, 2) как добавка к моторному топливу, 3) галогенопроизводные бензола – пестициды,4) для синтеза органических соединений (лекарств, пластмасс, красителей, взрывчатых и душистых веществ). №7 Физические свойства метанол и этанол – жидкости с алкогольным запахом, растворимые в воде. Метанол – яд (5-10 мл вызывает тяжелое отравление, 30 мл – смертельный исход). Химические свойства: 1) Горение: С2Н5ОН + 3О2 → 2СО2 ↑+ 3Н2О; 2) С активными металлами: 2С2Н5ОН + 2Na → 2С2Н5О Na +Н2 (алкоголяты); 3) Качественная реакция: С2Н5ОН + CuO → СН3COH + Cu + Н2 О; 4) При нагревании спиртов в присутствии серной кислоты происходит дегидратация:
а) межмолекулярная: С2Н5ОН + НОС2Н5 → С2Н5ОС2Н5 + Н2О (t ‹ 1400); б) внутримолекулярная: С2Н5ОН → С2Н4 + Н2О (t › 1400); Получение этанола: 1) из этилена: С2Н4 + НОН → С2Н5ОН; 2) Сбраживание глюкозы: С6Н12О6 → 2С2Н5ОН + 2СО2 ↑; 3) Гидролиз крахмала и сбраживание глюкозы; 4) Гидролиз клетчатки и сбраживание глюкозы. Применение этанола для производства: 1 ) уксусной кислоты, 2) лекарств, 3) напитков, 4) духов, одеколонов, 5) каучука, 6) лаков, красок, 7) как растворитель. Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки. 1 марта 1869 г Д. И. Менделеев сформулировал периодический закон: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов (масс) элементов. В соответствии закону была составлена периодическая система элементов – графическое изображение периодического закона.
|
|||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 127; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.35.148 (0.028 с.) |