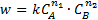Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость скорости от концентрации реагирующих веществ
Зависимость скорости реакции от концентрации реагирующих веществ определяет основной постулат химической кинетики: скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции при условиях постоянства всех остальных факторов (температуры, состава). Например, если реагируют вещества А и В, то
где k - константа скорости реакции; ni –порядок реакции по данному i -му реагенту.
Это аналитическое выражение закона, установленного в 1867 году норвежскими учеными К. М. Гульдбергом и П. Вааге. Он известен под названием закона действующих масс.
Коэффициент пропорциональности k называется константой скорости химической реакции. Константа скорости реакции k численно равна скорости реакции, если концентрации всех участников реакции равны единице. По физическому смыслу константа скорости – это удельная скорость реакции или стандартная скорость (при ci =1), поэтому еѐ величина зависит от всех факторов, которые влияют на скорость реакции, за исключением концентрации реагирующих веществ. Единицы ее измерения определяются видом кинетического уравнения. Порядок реакции
Порядок реакции определяется величиной показателя степени в кинетическом уравнении реакции. Каждый из показателей степени при концентрациях (n 1 и n 2) выражает частный порядок реакции по данному компоненту. Сумма показателей степени при концентрациях (n 1+ n 2) определяет полный порядок реакции. n = n1 + n2. Он может принимать целые, дробные, положительные, отрицательные, а также нулевые значения. Если стехиометрическое уравнение правильно отражает истинный механизм реакции, то n 1 =a и n 2 =b. Только для простых реакций уравнение скорости соответствует стехиометрическому уравнению. Порядок реакции понятие формальное, поскольку в большинстве случаев не отражает механизма реакции. Определяется порядок реакции экспериментально и отражает зависимость скорости реакции от концентрации вещества. Если скорость реакции не зависит от концентрации реагирующих веществ, то реакция имеет нулевой порядок. Если скорость реакции зависит от концентрации вещества в первой степени, то это реакция первого порядка; если во второй степени, то это реакция второго порядка и так далее.
Молекулярность реакции Химический процесс протекает через ряд последовательных стадий, состоящих из множества одинаковых повторных превращений – элементарных актов. Число молекул (частиц), принимающих участие в элементарном акте химического превращения, называется молекулярностью реакции. Молекулярность реакции всегда целочисленна, положительна и не превышает трех. Различают следующие реакции: -мономолекулярные, в которых только один вид молекул претерпевает превращение, причем стехиометрический коэффициент в уравнении равен единице, например: A → C или A → C + D; Примером монолекулярных реакций могут служить реакции изомеризации (внутримолекулярной перегруппировки), термического разложения: СНзNСНз → С2Н6 + N2 (разложение азометана); CH3OCH3 → CH4 + H2 + CO (разложение диметилового эфира). -бимолекулярные, в элементарном акте участвуют две молекулы, например: 2A → C; A + B → C; A + B → C + D; Примеры: H2 + J2 → 2HJ; CH3COOH + C2H5OH → CH3COOC2H5 + H2O. -тримолекулярные, в элементарном акте участвуют три молекулы, например: A + B + C → M; 3A → M; A + B + C → M + N. Вероятность одновременного столкновения сразу трех и большего числа молекул меньше, чем вероятность столкновения двух молекул. Поэтому тримолекулярные реакции менее вероятны, чем бимолекулярные. Тримолекулярных реакции: 2NO + H2 → N2O + H2O; 2NO + O2 → 2NO2.
Молекулярность - это теоретическое понятие. Она отражает механизм реакции, дает представление о том какие именно и через какие стадии идет образование продуктов. В простых (элементарных) реакциях, протекающих в одну стадию порядок реакции и молекулярность совпадают и имеют целое положительное значение. Для большинства реакций порядок реакции меньше молекулярности. Чаще всего молекулярность и порядок реакции различны из-за сложного механизма протекания реакций. Зачастую одна из стадий сложной реакции является более медленной, лимитирующей ее течение и определяющей скорость всего процесса в целом. Порядок реакции в таком случае равен молекулярности этой самой медленной стадии.
Другой причиной расхождения между молекулярностью и порядком реакции может быть значительный избыток одного из реагентов в реакционной смеси. Тогда концентрация этого реагента остается практически постоянной в течение реакции, а порядок реакции будет меньше, чем определенный по стехиометрическому уравнению.
Случаи несовпадения порядка реакции и молекулярности: 1) Большой избыток одного из реагирующих веществ. 2) Для гетерогенных реакций учитывается концентрация только газообразных веществ. 3) Сложный механизм реакции.
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 46; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.228.40 (0.007 с.) |