Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства производных карбоновых кислот.
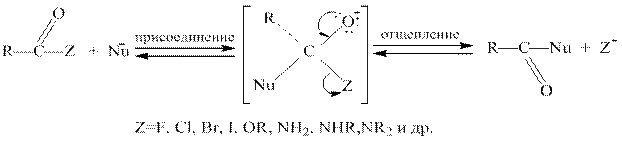
Функциональные производные, подобно карбоновым кислотам, способны вступать в реакции ацилирования, которые приводят к образованию других функциональных производных карбоновых кислот.
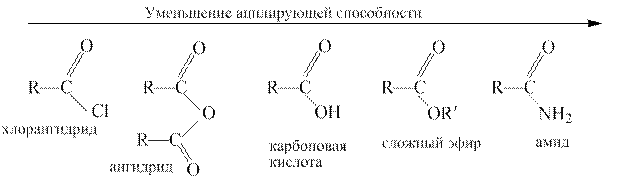
В общем случае реакция обратима, однако если Z и Nu сильно различаются по своей основности и нуклеофильности, она становится необратимой. Наибольшей ацилирующей активностью обладают галогенангидриды и ангидриды, так как их ацильные остатки соединены с хорошо уходящими группами – галогенид-ионами и анионами карбоновых кислот. Сложные эфиры и амиды проявляют более низкую ацилирующую способность, потому что соответственно алкоксид- и амид-ионы не относятся к стабильным анионам и не являются хорошо уходящими группами.
3. Галогенангидриды. Галогенангидридами называются функциональные производные карбоновых кислот общей формулы RC(O) Hal. Галогенангидриды представляют собой жидкости или твердые вещества с резким навязчивым запахом, сильно раздражают кожу и слизистые оболочки. Практическое значение имеют ацилхлориды и ацилбромиды.
Реакции ацилирования.
Галогенангидриды относятся к наиболее активным ацилирующим агентам, их используют для получения большинства других функциональных производных карбоновых кислот [реакции (2) – (6)]. Ацилгалогениды очень легко гидролизуются в карбоновые кислоты [реакция(1)].С помощью галогенангидридов удается проацилировать такие соединения, которые не реагируют с другими ацилирующими агентами, например, третичные спирты и фенолы.
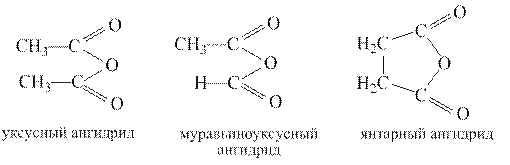
Ангидриды Ангидридами называются функциональные производные карбоновых кислот общей формулы RC(O)OC(O)R/ Ангидриды можно рассматривать как продукты отщепления воды от карбоксильных групп двух молекул монокарбоновой кислоты или одной молекулы дикарбоновой кислоты.
Ангидриды представляют собой жидкости или твердые вещества, низшие ангидриды имеют раздражающий запах, похожий на запах соответствующей кислоты. Реакции ацилирования. Реакции ацилирования протекают в условиях как кислотного, так и основного катализа или без катализатора Высокая ацилирующая способность ангидридов используется для получения большинства функциональных производных карбоновых кислот, как показано на примере уксусного ангидрида:
Сложные эфиры.
Сложными эфирами называются функциональные производные карбоновых кислот общей формулы RC (O) OR /. Сложные эфиры низших спиртов и карбоновых кислот представляют собой летучие жидкости с приятным запахом, плохо растворимые в воде и хорошо – в большинстве органических растворителей. Запахи сложных эфиров напоминают запахи разных фруктов и цветов. Например, запах жасмина - бензилпропаноат, хризантемы – сложный эфир фенилэтилового спирта и муравьиной кислоты. Сложные эфиры, которые имеют цветочные запахи, это чаще всего производные ароматических кислот или ароматических спиртов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Воски не растворяются в воде. Примерами животных восков могут служить пчелиный воск, а также ворвань (спермацет), содержащийся в черепной коробке кашалота (кашалотовый воск). Пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат): CH3(CH2)14–CO–O–(CH2)29CH3. Гидролиз. Важнейшей из реакций ацилирования является гидролиз сложных эфиров с образованием спирта и карбоновой кислоты:
Реакция осуществляется как в кислой, так и в щелочной среде. Смещение равновесия в сторону образования спирта и кислоты обеспечивается добавлением избытка воды. Щелочной гидролиз необратим, в процессе реакции на моль эфира расходуется моль щелочи, т.е. щелочь в этой реакции выступает в качестве расходуемого реагента, а не катализатора:
Восстановление.
Сложные эфиры чаще восстанавливают в первичные спирты, реже в альдегиды или простые эфиры. Обычно для восстановления используют алюмогидрид лития.
Аммонолиз. При нагревании эфиров карбоновых кислот с аммиаком и аминами образуются амиды:
Амиды.
Амидами называются функциональные производные карбоновых кислот общей формулы R ─ C (O)─ NH 2- n R ' n, где n =0-2. В незамещенных амидах ацильный остаток соединен с незамещенной аминогруппой, а в N -замещенных амидах один из атомов водорода замещен одним алкильным или арильным радикалом, в N, N -дизамещенных – атомы водорода аминогруппы замещены двумя радикалами.
Амиды представляют собой кристаллические вещества с относительно высокими и четкими температурами плавления, что позволяет использовать некоторые из амидов в качестве производных для идентификации карбоновых кислот.
Кислотно-основные свойства.
Амиды обладают слабыми как кислотными, так и основными свойствами. Причиной пониженной основности аминогруппы в амидах является сопряжение неподеленной пары электронов атома азота с карбонильной группой. При взаимодействии с сильными кислотами амиды протонируются по атому кислорода как в разбавленных, так и в концентрированных растворах кислот.
Кислотно-основное взаимодействие лежит в основе образования амидами межмолекулярных ассоциатов, существованием которых объясняются высокие температуры плавления и кипения амидов. Возможно существование двух типов ассоциатов: линейных полимеров и циклических димеров.
Реакции ацилирования. Из числа реакций ацилирования практическое значение имеет гидролиз амидов, который можно проводить в кислой и щелочной средах. Амиды гидролизуются намного труднее, чем другие функциональные производные карбоновых кислот. Гидролиз амидов проводится в более жестких условиях по сравнению с гидролизом сложных эфиров. Кислотный гидролиз амидов – необратимая реакция, приводящая к образованию карбоновой кислоты и аммониевой соли:
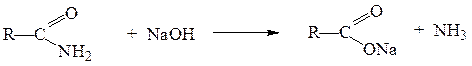
Щелочной гидролиз тоже необратимая реакция; в результате её образуется соль карбоновой кислоты и аммиак или амин:
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 118; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.137.243 (0.008 с.) |