Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Интерпретация результатов педагогического экспериментаСодержание книги
Поиск на нашем сайте
С учащимися 11 класса школы № 8 мы провели анкетирование (приложение 3) с целью проверки результатов эффективности разработанной нами методики. Результаты:
1 вопрос:
2 вопрос:
3 вопрос:
4 вопрос: Проанализировав самостоятельные работы учащихся 11 классов школы № 23 по содержанию, стало видно, что у учащихся экспериментального 11 "Б" класса записи были четкими, лаконичны, последовательны, ответы давались грамотным химическим языком, с использованием правил составления и преобразования, операций с химическими знаками. Можно сделать вывод формирование всей группы понятий в теме "ОВР", а также можно наблюдать прогнозирование на основе символики. Учащиеся контрольного 11 "А" класса успешно справились с заданием, но не прослеживалось особой четкости в записях, "ломанный" химический язык наблюдался практически во всех работах, большинство придерживалось образцов, рассмотренных на уроках, не проявляя своей инициативы. Результаты проверки решения самостоятельной работы приведены в таблице (таблица 4) и изображены в виде гистограммы (рис 1. – приложение 5). Таблица 4.
Анкетирование с учащимися 11 класса 23 школы представлены 9. На основании проведенного эксперимента в школах № 8 и № 23 можно сделать следующие выводы: Степень сформированности групп умений пользоваться химическим языком в экспериментальном классе выше, чем в контрольном: об этом свидетельствует количество отличных оценок (приложение 6), а также само оформление работы. У учащихся экспериментального класса знания систематизированные, четкие, построенные грамотным химическим языком. Отмечается моделирование вариантов записей, прогнозирование на основе химической символики. У учащихся контрольного класса такие показатели наблюдалось лишь у некоторых человек, остальным не удалось выполнить задания в полной мере, используя язык химической науки. Сформированные умения пользоваться химическим языком позволяют рационализировать учебно-познавательный процесс, активизирует мышление учащихся, стимулируют развитие самостоятельной деятельности.
Заключение
В соответствии с поставленной целью выпускной работы – формирование умений пользоваться химическим языком – было сделано следующее: Проанализировано состояние проблемы методики формирования умений пользоваться химическим языком в средней школе в трудах различных авторов и в практике школьного преподавания. Выявлено, что умения пользоваться химическим языком являются рациональным компонентом учебно-познавательного процесса, стимулируя развитие мышления, творчества и самостоятельной деятельности учащихся. Разработана конкретная методика формирования умений пользоваться химическим языком в 11 классе при изучении темы: "Окислительно-восстановительные реакции". С целью оценки эффективности применения методики формирования у школьников умений в средней школе № 23 г. Калуги проведен сравнительный педагогический эксперимент, в школе № 8 применение методики. Проанализированы результаты эксперимента: по времени выполнения заданий. Решение этих задач, итоги эксперимента, беседа с учащимися и результаты выполнения ими работ – все это позволяет сделать общий вывод, что методика формирования умений повышает качество знаний учащихся, совершенствует их навыки в выполнении основных заданий по химии, способствует развитию творчества, самостоятельности, активной мыслительной деятельности, повышает интерес к предмету. Этот вывод подтверждает выдвинутую в начале работы гипотезу. Список литературы
1. Александрова М.А. Урок "Электролиз растворов и расплавов солей" // Химия в школе. - 2005. - № 3 - с.61-66. 2. Алексинский В.Н. занимательные опыты по химии: Книга для учителей. – 2-е изд., испр. – М.: Просвещение, 1995. – 96 с.: ил. 3. Ахметов Н.С. Общая и неорганическая химия. Учеб. для вузов. – 4-е изд., испр. – М.: Высш. шк.; 2002. – 743 с.: ил. 4. Ахлебинин А.К., Ахлебинина Т.В., Карпов В.А., Лазыкина Л.Г., Ларионова В.М., Лихачев В.Н., Майерли А.А., Нифантьев Э.Е., Чайков С.Г., "1С: Образовательная коллекция. Химия для всех – XXI: Химические опыты со взрывами и без". Мультимедийный компакт-диск с комплектом программ для поддержки школьного курса химии. "1С". 2002. – 283 МБ. 5. Балаев И.И. Домашний эксперимент по химии. Пособие для учителя. Из опыта работы. – М.: Просвещение, 1977. – 126 с. 6. Балуева Г.А., Осокина Д.Н. Все мы дома химики. – М.: Химия, 1979. – 128 с.: ил. 7. Герасимова Н.Ф., Смирнова Т.В., Супоницкая И.И. Опорный конспект в обобщении знаний о коррозии и защите металлов // Химия в школе. – 1997. - № 7 – с.40-42. 8. Герус С.А. Теория и практика рационализации процесса обучения химии в средней школе: Монография. – СПб.: Изд-во РГПУ им.А.И. Герцена, 2003. – 160 с. 9. Грибакина Л.В., Кузнецова Н.Е. О причинах формализма в знаниях учащихся // Химия в школе. - 1988. - № 6. – с.17-18. 10. Единый государственный экзамен 2001: Тестовые задания: Химия / М.Г. Минин, Н.С. Михайлова, В.Ф. Гридаев и др.: М-во образования РФ. - М.: Просвещение, 2001. – 47с.: ил. 11. Жуков С.Т. Аликберов Л.Ю. Окислительно-восстановительные реакции. Часть 5. Природа вещества и процессы окисления – восстановления // Химия в школе. – 2005. - №1 с.36-42. 12. Журин А.А. Окислительно-восстановительные реакции. – М.: Аквариум, 1998. – 256 с. 13. Кузнецова Л.М. Причины формализма в знаниях учащихся и пути его устранения // Химия в школе. – 1990. - № 3 – с.16-19. 14. Кузнецова Н.Е. Формирование систем понятий в обучении химии. – М.: Просвещение, 1989. – 144 с.: ил. 15. Кузнецова Н.Е. Шорова Ж.И. Изучение химического языка на первых этапе обучения // Химия в школе. – 1981. - № 5 – с.41-44. 16. Методика преподавания химии / Под ред. Н.Е. Кузнецовой. – М.: Просвещение, 1984. – 415 с. 17. Новые образовательные стандарты по химии // Химия: Методика преподавания. – 2004. - № 7 – с.3-8. 18. Ожегов С.И. Словарь русского языка: 70 000 слов/ Под ред.Н.Ю. Шведовой – 21-е изд., перераб. И доп. – М.: Рус. Яз., 1989. – 924 с. 19. Программы по химии для 8-11 классов общеобразовательных учреждений / Под ред. Н.Е. Кузнецовой. – М.: Вентана-Граф, 2006. – 128 с. 20. Программно-методические материалы. Химия: Средняя школа.8-11 кл. / Сост. С.В. Суматохин. - 4-е изд., перераб. И до. – М.: Дрофа, 2001. – 192 с. 21. Радаева О.В. Роль научного языка на уроках химии // Химия: Методика преподавания. – 2005. - №7 – с.27-29. 22. Рогожин О.В. развитие интеллектуальных умений школьников // Химия: Методика преподавания. – 2004. - №5 – с.43-47. 23. Степин Б.Д. Аликберова А.Ю. Занимательные задания и эффективные опыты по химии. – М.: Дрофа, 2002. – 432 с.: ил. 24. Суматохин С.В. О приоритетных направлениях развития общего химического образования и использование учебных заданий по химии в 2005/06 уч. году // Химия: Методика преподавания. – 2005. - №5 – с. 20-27. 25. Теория и практика интегративно-модульного обучения общей химии студентов медицинского вуза. / Т.Н. Литвинова. Краснодар: Издательство Кубанской государственной медицинской академии, 2001. – 265 с. 26. Химии: 11 класс: Учеб. Для общеобразовательных учреждений/ О.С. Габриелян Г.Г. Лысова. – 2-е изд., испр. – М.: Дрофа, 2002. – 368 с.: ил. 27. Химия: Учебник для учащихся 8 класса общеобразовательных учреждений / Кузнецова Н.Е., Титова И.М. и др. – 2-е изд., перераб. – М.: Вентана-Граф, 2005. - 224 с.: ил. 28. Химия: Учебник для учащихся 9 класса общеобразовательных учреждений / Кузнецова Н.Е., Титова И.М. и др. – М.: Вентана-Граф, 2005. - 234 с.: ил. 29. Химия: Учебник для учащихся 11 класса общеобразовательных учреждений в 2 частях / Кузнецова Н.Е., Левкина И.М. и др. – 2-е изд., перераб. – М.: Вентана-Граф, 2006. - 424 с.: ил. 30. Хомченко Г.П. Севастьянова К.И. Окислительно-восстановительные реакции: Книга для внеклассного чтения учащихся 8-10 кл. сред. Шк. – 3-е изд., перераб. – М.: Просвещение, 1989. – 141 с. 31. Шаповаленко С.Г. Методика обучения химии в восьмилетней и средней школе. – М.: Учпедгиз, 1963. – 667. 32. Фаязов Д.Ф. Формирование умений учащихся пользоваться химическим языком // Химия в школе. – 1983. - № 2 – с.33-34. Приложение 1
Варианты самостоятельных работ к уроку №2. Тема: "Окислительно-восстановительные реакции". II вариант 1. Дать определение понятию восстановитель, приведите примеры процесса. 2. Укажите коэффициент перед окислителем в реакции Cu+ H2SO4(конц) →CuSO4+H2O+SO2: а) 2; б) 3; в) 4; г) 1. 3. Сера проявляет восстановительные свойства в реакции: а) Br2 + H2S → S + HBr; в) S+F2→SF6; б) SO2+Na2O→Na2SO3; г) Mg+ H2SO4→MgSO4+ H2O. 4. Сумма коэффициентов в уравнении реакции N2+H2↔NH3 составляет: а) 3; б) 4; в) 6; г) 5. 5. Сильнее окислительные свойства будут выражены: а) Cl1+; б) Cl1-; в) Cl3+; г) Cl5+. 6. Недостающим продуктом реакции Mg+HNO3(конц) = Mg(NO3) 2+…. +H2O является: а) NH4NO3; б) N2O; в) NO; г) NO2. III вариант 1. Дать определение понятию "процесс окисления", приведите примеры. 2. Углерод НЕ проявляет восстановительные свойства в реакции: а) C+H2 → CH4; в) MgO+ CO2→Mg+CO; б) FeO +CO→Fe+CO2; г) Al+C→Al4C3. 3. Укажите коэффициент перед восстановителем в реакции C+ H2SO4(конц) →CO2+H2O+SO2 а) 1; б) 2; в) 3; г) 4. 4. Сумма коэффициентов в уравнении реакции SO2+O2↔SO3 составляет: а) 3; б) 4; в) 5; г) 6. 5. Сильнее окислительные свойства будут выражены: а) S2 -; б) S0; в) S2+; г) S4+. 6. Недостающим продуктом реакции S+ HNO3(конц) → SO2+ H2O+…является а) NO2; б) NO; в) N2; г) NH4NO3. IV вариант 1. Дать определение понятию "восстановление", приведите примеры процесса. 2. Сера проявляет окислительные свойства в реакции: а) О2 + H2S → SO2+ H2O; в) Mg + H2SO4→Mg SO4+ H2; б) S + H2→ H2S; г) Br2 + H2S → S + HBr. 3. Укажите коэффициент перед окислителем в реакции C+ HNO3(разб) → СO2+ H2O+ NO а) 3; б) 4; в) 5; г) 6. 4. Сумма коэффициентов в уравнении реакции H2O→H2+O2 составляет: а) 5; б) 4; в) 3; г) 2. 5. Сильнее восстановительные свойства будут выражены а) Mn7+; б) Mn0; в) Mn2+; г) Mn4+. 6. Недостающим продуктом реакции Р+ HNO3(конц) → Р2O5+ H2O+…является а) NO2; б) NO; в) N2; г) NH4NO3. ОТВЕТЫ
Приложение 2
Варианты самостоятельных работ к уроку №3. Тема: "Коррозия металлов". II вариант 1. Допишите уравнение реакции, расставьте коэффициенты методом электронного баланса и определите тип ОВР: а) Р + H2SO4(конц) →… 2. На рисунке изображен разрез никелированного железного листа. Определите, что такое 1 и 2, напишите схемы катодного и анодного процессов. H2O (O2)
3. Разделите вещества K2SO4, N2O, HCl, Zn, HBrO на три группы: 1 - проявляющие только окислительные свойства; 2 - проявляющие только восстановительные свойства; 3 - проявляющие как окислительные, так и восстановительные свойства. 4. При электролизе раствора NaОН на аноде выделяется: а) натрий; б) кислород; в) водород? 5. При электролизе расплава хлорида ртути на катоде выделяется: а) ртуть; б) хлор; в) кислород? III вариант 1. Допишите уравнение реакции, расставьте коэффициенты методом электронного баланса и определите тип ОВР: а) Fe + HNO3(конц) → … 2. На рисунке изображен разрез луженого железного листа. Определите, что такое 1 и 2, напишите схемы катодного и анодного процессов. H2O (O2)
3. Разделите вещества K2SO3, Li, HClO4, HNO2, K2Cr2O7 на три группы: 1 - проявляющие только окислительные свойства; 2 - проявляющие только восстановительные свойства; 3 - проявляющие как окислительные, так и восстановительные свойства. 4. При электролизе раствора Ba(ОН) 2 на аноде выделяется: а) водород; б) кислород; в) барий? 5. При электролизе расплава хлорида свинца (II) на катоде выделяется: а) свинец; б) хлор; в) процесс не возможен? IV вариант 1. Допишите уравнение реакции, расставьте коэффициенты методом электронного баланса и определите тип ОВР: а) Hg + H2SO4(конц) →…
2. На рисунке изображен разрез оцинкованного железного листа. Определите, что такое 1 и 2, напишите схемы катодного и анодного процессов. H2O (O2)
3. Разделите вещества SO2, Fe, KMnO4, N2O3, CrO3 на три группы: 1 - проявляющие только окислительные свойства; 2 - проявляющие только восстановительные свойства; 3 - проявляющие как окислительные, так и восстановительные свойства. 4. При электролизе раствора Cu(NO3) 2 на катоде выделяется: а) медь; б) кислород; в) водород? 5. При электролизе раствора хлорида алюминия алюминий выделяется: а) на катоде; б) на аноде; в) остается в растворе? ОТВЕТЫ
Приложение 3
Вопросы анкеты для учащихся: 1. На сколько сложной для изучения вам показалась данная тема? 2. Быстро ли проходили уроки? 3. Как вы считаете, полученные вами знания помогут вам в дальнейшем при изучении предмета? 4. Появилось ли у вас желание самостоятельно составлять уравнения ОВР? Приложение 4 Разработка планов уроков для контрольного класса (по учебнику О.С. Габриеляна). Урок № 1. Тема: "Классификация химических реакций" Цель: обобщить и расширить представление учащихся о классификации химических реакций. Оборудование: сера, спиртовка, зажим, кристаллизатор с водой, магний, щипцы,, H2SO4, BaCl2, H2O2, MnO2, мультимедийные проектор, диск, компьютер. Тип урока: обобщение и систематизация знаний. Ход урока: Организация класса. Изучение нового материала. Учащиеся самостоятельно по учебнику (§ 11, стр.100-111) заполняют таблицу (25 мин)"Классификация химических реакций".
В конце урока учитель демонстрирует опыты, учащиеся классифицируют реакции по шести признакам, записанным в таблице: 1. переход кристаллической серы в пластическую; 2. горение магния; 3. разложение малахита; 4. взаимодействие раствора иодида калия с хлорной водой; 5. взаимодействие раствора серной кислоты с хлоридом бария; 6. разложение пероксида водорода под действием оксида марганца (IV). 7. взаимодействие меди с концентрированным раствором азотной кислоты. Рассмотрение метода электронного баланса (на примере последней реакции):
1 2 Cu0 - 2ê → Cu2+процесс окисления, медь – восстановитель 2 N5+ + ê → N4+процесс восстановления, кислота – окислитель Cu + 4HNO3(конц) = Cu(NO3) 2+ 2NO2 +2H2O. Итоги урока. Домашнее задание: § 11, упр.1,6. Урок № 2. Тема: "Коррозия металлов". Цель: актуализировать, расширить и углубить знания учащихся о коррозии металлов. Оборудование: образцы "чистого" и ржавого железа, металлических изделий, защищенных от коррозии покрытиями. Тип урока: комбинированный. Ход урока: Организация класса. Проверка домашнего задания (5-7 мин). Самостоятельная работа: составить 5 уравнений реакций металла с разными классами веществ. Работа выполняется по вариантам: I – натрий, II – цинк, III – алюминий, IV – железо. Изучение нового материала. Прочитайте о коррозии в учебнике на стр. 208-210. Выпишите определение коррозии. Запишите классификацию видов коррозии по характеру воздействия на металлическую поверхность и по химизму. Запишите примеры химической коррозии. в какой среде она происходит? Запишите, в какой среде происходит электрохимическая коррозия. Далее учитель объясняет, что электрохимическая коррозия при контакте двух металлов, это приводит к образованию гальванической пары, в которой более активный металл отдает свой электроны менее активному и разрушается: Fe0 - 2ê → Fe2+, а на поверхности менее активного металла идет восстановление в кислой среде: 2H+ +2ê → H2 ↑; в нейтральной среде или щелочной: 2H2O + 2ê→ 2OH - + H2 ↑. Поэтому в нейтральной и щелочной среде образуется гидроксиды железа Fe2+ + 2OH - → Fe(OH) 2; 4 Fe(OH) 2 + 2H2O + O2 → 4Fe(OH) 3; Fe(OH) 3 → FeO(OH) + H2O. В кислой среде ржавчина не образуется, ионы металла переходят в раствор: Fe0 + 2H+ → Fe2+ + H2 ↑. ИТОГИ УРОКА IV. Домашнее задание: § 18 стр. 208-214. Выписать в тетрадь способы защиты от коррозии, упр.16-20.
Урок № 3. Тема: "Способы получения металлов". Цель: актуализировать и обобщить знания учащихся о способах получения металлов. Оборудование: коллекция "Руды металлов". Тип урока: комбинированный. Ход урока: Организация класса. Проверка домашнего задания (10-12 мин). Ученик у доски заполняет таблицу о способах защиты металла. В это время проводится устный опрос класса по вопросам: Что такое коррозия? Какие виды коррозии вы знаете? Приведите примеры. Какова сущность основных видов коррозии? Изучение нового материала (20 мин). Прочитайте учебник на стр.214-216 и сделайте записи по плану: определение металлургии; 2) способы получения, сущность процессов, примеры. Электролиз - окислительно-восстановительная реакция, протекающая под действием постоянного электрического тока на электродах, погруженных в раствор или расплав электролита. Что такое электролиты? Почему электролиты являются участниками электролиза? электролиз расплавоврастворов Правила определения продуктов электролиза расплавов и растворов электролитов (схемы представлены на каждого ученика). I. Катодные процессы электрохимический ряд напряжений металлов Li Rb K Ba Ca Na Mg Mn Zn Cr Fe Pb Cu Hg Ag Pt Au восстановление H2Oвосстановление H2O и восстановление H2O + 2ê →H2 +2OH - металла Men+ + nê→Me0 металла усиление окислительных свойств катионов II. Анодные процессы анионы бескислородсодержащиекислородсодержащие галогенид-ионы OH -, NO3-, SO42- 2 Cl - - 2ê → Cl2↑ 2H2O - 4ê→O2+4H+; 4OH - - 4ê→O2+2H2O. I - Br S2 - Cl - OH - SO42 - NO3 - F - ослабление восстановительной способности анионов Применение электролиза: покрытие металлов; защита от коррозии; получение металлов и других соединений; очистка веществ от примесей. Опираясь на правила, составим уравнение электролиза раствора иодида калия и расплава хлорида меди (II). а) KI + H2O → К (-): К+; H2O H2O + 2ê →H2 +2OH - восстановление А (+): I-; H2O2 I - - 2ê → I2 окисление 2KI + H2O → 2KOH + I2 + H2 ↑. б) CuCl2 расплав→ К (-): Cu2+ Cu2+ + 2ê → Cu0 восстановление А (+): Cl- 2 Cl - - 2ê → Cl2↑ окисление CuCl2 расплав→ Cu0 + Cl2↑. Вода не является участником процесса расплава веществ. Итоги урока. Домашнее задание: § 18, оформить записи, выполнить задание: Составьте уравнение электролиза: а) раствора бромида железа (II); б) расплава оксида алюминия; в) раствора нитрата ртути; г) раствора иодида никеля (II); д) раствора серной кислоты. Подготовка к контрольной работе. Фрагмент урока № 4 Тема: " Решение задач и упражнений по теме "Металлы". Цель: Закрепит знания по теме, отработать умение составления уравнений реакций с участием металлов. Ход урока: Организация класса. Проверка домашнего задания (12-15 мин). Выполнение самостоятельной работы. I вариант 1. Допишите уравнение реакции, расставьте коэффициенты методом электронного баланса и определите тип ОВР: а) Co+ HNO3(конц) →... 2. На рисунке изображен разрез хромированного железного листа. Определите, что такое 1 и 2, напишите схемы катодного и анодного процессов.
H2O (O2) 3. Разделите вещества HNO3, KClO4, H2O2, Mg, NH3 на три группы: 1 - проявляющие только окислительные свойства; 2 - проявляющие только восстановительные свойства; 3 - проявляющие как окислительные, так и восстановительные свойства. 4. При электролизе раствора КОН на катоде выделится: а) водород; б) кислород; в) калий? 5. При электролизе раствора хлорида бария на аноде выделяется: а) водород; б) хлор; в) кислород? Остальные варианты – приложение 2. Приложение
Занимательные задания (оформление стендов в кабинете) 1. Поджигает … вода! Если смешать порошок металла (цинка или алюминия) с измельченными кристаллами некоторого неметалла, а потом добавить каплю воды, начинается бурная окислительно-восстановительная реакция с выделением теплоты, света и фиолетовых паров. Что это за реакция? 2. Первые спички Немецкий химик Ян Каммерер работал учителем химии. В 1820 г. он показал своим ученикам рискованный опыт. Смешав под водой воскообразное белое вещество с бесцветным кристаллами соли, полученной французским химиком Бертолле и названной его именем, он добавил клей, а потом погрузил в образовавшееся "тесто" пучок осиновых палочек. Затем палочки были извлечены из смеси и осторожно высушены. Каммерер раздал палочки своим подопечным и попросил провести ими по поверхности стола. Все палочки воспламенились, ученики были в восторге: ведь они держали в руках первые спички. Какие вещества использовал Каммерер? 3. Химический хамелеон В ХIХ в. для химического анализа различных веществ применялся раствор "хамелеона". В исходном состоянии он был фиолетовым, а при реакциях с восстановителями в кислотной среде обесцвечивался. Если реакции протекали при большом избытке щелочи, раствор становился зеленым. А в нейтральной среде восстановители делали "хамелеона" буро-коричневым. О каком веществе идет речь? 4. Медные фокусы В 1928 г. чешский химик И. Друце обнаружил, что, если медные стружки залить концентрированной серной кислотой и нагреть до 2000C, получается раствор зеленого цвета. При смешивании этого раствора с безводным метанолом (метиловым спиртом) выпадает белый осадок. Друце попытался растворить этот осадок в воде и получил раствор голубого цвета, а на дне сосуда оказались крупинки металлической меди. Какое вещество получил Друце? 5. Алюминий подвел! Железную водосточную трубу закрепили на стене дома хомутами из алюминиевого сплава. Через несколько лет во время сильного дождя труба рухнула на тротуар. Оказалось, что крепежные детали из алюминиевого сплава подверглись сильной коррозии, хотя кровля дома, сделанная из того же сплава, безупречно служила уже полтора десятка лет, Почему так сильно отличалось поведение алюминиевых изделий? 6. Обновили!... Серебряные столовые приборы часто украшают "черненым" рисунком. Подобные узоры можно встретить и на мельхиоровых ложках, вилках и ножах. Однажды после званого ужина все ложки, вилки и ножи, залив мыльной водой, оставили в тазике из оцинкованного железа. Наутро оказалось, что все приборы из серебра и мельхиора стали белыми как снег, а столь ценный "черненый" рисунок пропал. Что же произошло? 7. Химическая "угадай-ка" В руки учеников попали обрывки бумаги - черновики учителя, готовившего задания для контрольной работы. Все коэффициенты в уравнениях реакций были поставлены правильно. какие же вещества вступили в реакции, если получились следующие продуты:
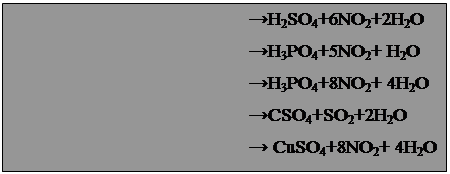
8. Ошибка лаборанта Для получения сероводорода на лекциях использовали аппарат Киппа с кусочками сульфида железа и разбавленной соляной кислотой. Но вот на очередную лекцию лаборант вынес аппарат, все внутренние стенки которого были покрыты беловато-желтым налетом, а вместо прозрачного раствора кислоты пузырилась мутная, слегка желтоватая жидкость. Профессор потребовал немедленно унести аппарат и перезарядить его, так как вместо разбавленной соляной в нем оказалась серная кислота, к тому же концентрированная. Что произошло в аппарате Киппа? 9. Цепочка серебряных превращений Химик исследовал поведение иода и серебра в растворах разного с става. Сначала он высыпал порошок иода в нагретый водный раствор гидроксида калия и получил прозрачный бесцветный раствор. После охлаждения он добавил к этому раствору избыток нитрата серебра и получил осадок светло-желтого цвета. Химик фильтрованием отделил раствора осадок, промыл его водой и обработал избытком раствора аммиака. Он заметил, что только часть осадка перешла в раствор, а оставшаяся часть стала более желтой; этот остаток был перенесен в водный раствор сульфида натрия. Выпал черный осадок, который под действием азотной кислоты пожелтел, и при этом выделился бесцветный газ, буреющий на воздухе. Каков состав получаемых при этих превращениях веществ и как реакции здесь протекают? 10. Простой вопрос Смесь цинка и сульфида цинка обработали концентрированной азотной кислотой и увидели выделение красно-бурого газа. К полученному бесцветному раствору добавили хлорид бария, и выпал белый осадок, нерастворимый в азотной кислоте. Какие вещества содержались в растворе над осадком? 11. Отважный реагент Студент неосмотрительно оставил на столе в фарфоровой чашке кусочек белого фосфора. Фосфор в скором времени вспыхнул, выделяя густые клубы дыма. Недолго думая, студент схватил первую попавшуюся колбу с голубым раствором и надписью "Отходы" и вылил ее содержимое на горящий фосфор. Пламя исчезло. Что это были за отходы, ни кто не знал. Однако студент отметил, что на кусочках фосфора, залитого "отходами", появился красно-коричневый налет. А добавление к остатку "отходов" сульфида натрия вызвало появление черного осадка. Помогите установить состав голубого раствора. 12. Подсказывает ряд напряжений Во время очередного занятия преподаватель обратил внимание учащихся на плакат "Электрохимический ряд напряжений" и подчеркнул два металла - кадмий (левее водорода) и ртуть (правее водорода). Он предложил провести опыты с этими металлами: сначала подействовать на них разбавленной серной кислотой, потом в раствор сульфата кадмия внести капельку ртути, а в раствор сульфата ртути - гранулу кадмия. Предскажите результаты этих опытов. 13. Насмешил! Студент-первокурсник не утруждал себя подготовкой к занятиям и насмешил всех, когда сделал в трех уравнениях реакций десять ошибок: NaCl + H2SO4(разб) = Cl2↑ + NaHSO4 NaBr + H2SO4(разб) = Br2↑ + NaHSO4 KJ + H2SO4(разб) = I2↑ + KHSO4 Найдите и исправьте ошибки. Ответы. При смешивании порошкообразного алюминия и тонко измельченных кристаллов иода и внесении в смесь капли воды начинается реакция 2Al + 3I2 = 2AlI3, которая сопровождается выделением теплоты и частичной возгонкой иода (фиолетовые пары). Вода в этой реакции выполняет роль катализатора. Каммерер использовал белый фосфор – P4 и бертолетову соль – хлорат калия KClO3. Гуммиарабик – природный клей. Воспламенение состава вызвано легкостью возгорания белого фосфора от трения. "Поставщиком" кислорода служит хлорат калия. Уравнения реакции таковы: P4 + 5O2 = P4O10, 2 KClO3 = 2 KCl + 3O2↑. Реакция перманганата калия ("хамелеона") со щавелевой кислотой H2C2O4, сульфитом натрия Na2SO3 и пероксидом водорода H2O2 протекают следующим образом: 5 H2C2O4 + 2 KMnO4 + 3 H2SO4 = 2 MnSO4 + 10 CO2 + K2SO4 + 8 H2O бесцветный Na2SO3 + 2 KMnO4 + 2 КОН = 2 K2MnO4 + Na2SO4 + H2O зеленый 3 H2O2 + 2 KMnO4 = 2 MnO2 ↓ + 3 O2 ↑ + 2 КОН + 2 H2O бурый осадок 4. Друце получил сульфат меди (I) Cu2SO4: 2 Cu + 2 H2SO4 = Cu2SO4 + SO2 ↑+ 2 H2O, который в водной среде подвергается дисмутации: Cu2SO4 = CuSO4 + Cu↓. 5. В местах соприкосновения железа и алюминия образуются "гальванические пары". Алюминий как более активный в химическом отношении металл играет роль анода – поставщика электронов, а железо – роль катода, принимающего электроны. Поэтому алюминиевые детали при контакте с железом очень быстро разрушаются, вместе с тем защищая от коррозии железные изделия. 6. Серебряную "чернь" наносят специально, это сульфидная "патина". В тазике серебро и цинк образовали гальваническую пару, где мыльная вода послужила электролитом, цинковая поверхность – катодом, а серебро – анодом. На аноде шло выделение водорода и из воды, а на аноде – кислорода. В результате сульфид серебра окислился и сульфидная патина обесцвечивалась: Ag2S + O2 = 2 Ag + SO2↑ 7. Вот уравнения этих реакций: S + 6 HNO3(конц) = H2SO4 + 6 NO2 + 2 H2O P + 5 HNO3(конц) = H3PO4 + 5 NO2 + H2O PH3 + 8 HNO3(конц) = H3PO4 + 8 NO2 + 4 H2O Cu + 2 H2SO4(конц) = CuSO4 + SO2 + 2 H2O CuS + 8 HNO3(конц) = CuSO4 + 8 NO2 + 4 H2O Sn + 4 HNO3(конц) = SnO2 + 4 NO2 + 2 H2O B + 3 HNO3(конц) = B(OH) 3 + 3 NO2. 8. В аппарате Киппа произошла реакция конмутации с выделением серы: 3 FeS + 4 H2SO4(конц) = 3 FeSO4 + 4 S↓ + 4 H2O. 9. В "цепочке" превращений протекали следующие реакции: 6 КОН + 3 I2 = 5 KI + KIO3 + 3 H2O, KI + AgNO3 = AgI↓ + KNO3, KIO3 + AgNO3 = AgIO3 ↓+ KNO3, AgIO3 + 2 NH3 = [Ag(NH3) 2] IO3, 2AgI+ Na2S =Ag2S+2NaI, 3Ag2S + 8HNO3(разб) = 6AgNO3 + 2NO+ 3S+ 4H2O. При обработке смеси азотной кислотой протекали реакции: Zn + 4 HNO3(конц) = Zn(NO3) 2 + 2 NO2 + 2 H2O, ZnS + 10 HNO3(конц) = Zn(NO3) 2 + 8 NO2 + H2SO4 + 4 H2O. При добавлении хлорида бария выпадает осадок сульфата бария, нерастворимого в кислотах: H2SO4 + BaCl2 = BaSO4 + 2 HCl. В растворе над осадком остается нитрат цинка Zn(NO3) 2 и соляная кислота HCl. В колбе находился водный раствор сульфата меди (II), который обезвреживает белый фосфор. При этом идет реакция: P4 + 10 CuSO4 + 16 H2O = 10 Cu + 4 H3PO4 +10 H2SO4. Добавление сульфида натрия к раствору CuSO4 ведет к выпадению черного осадка CuS: CuSO4 + Na2S = CuS + Na2SO4. Ртуть с разбавленной серной кислотой не взаимодействует, а кадмий участвует в реакции: Cd + H2SO4 = CdSO4 + H2. В водном растворе CdSO4 ртуть остается без изменений. В растворе HgSO4 кадмий покрывается мельчайшими капельками ртути, образуя амальгаму (сплав ртути и кадмия): HgSO4 + Cd = CdSO4 + Hg. Правильно будет так: NaCl + H2SO4(конц) = HCl↑ + NaHSO4 (обменная реакция без нагревания) 2 NaBr + 2 H2SO4(конц) = Br2 + SO2 + Na2SO4 + 2 H2O 8 KI + 5 H2SO4(конц) = 4 I2 + H2S + 4 K2SO4 + 4 H2O. Приложение 7
Домашний эксперимент на тему "Окислительно-восстановительные реакции". Цель работы: предварительная подготовка к изучению коррозии, закрепление материала. Опыт 1. Действие некоторых веществ на скорость коррозии металлов. Три гвоздика положите в три маленькие пробирочки. Пробирки вверх дном опустите во флаконы, в которые налейте по 2 мл воды, раствора хлорида натрия и добавьте каплю йодной настойки. Через двое суток отметьте, какие произошли изменения с гвоздями. Которые из них наиболее сильно разрушились? Одинаков ли внешний вид продуктов коррозии? Какие еще произошли изменения в пробирках? Напишите уравнение реакции. Вопросы учащимся: Почему нельзя хранить в химическом кабинете в одном и том же шкафу металлическое оборудование вместе с йодом, растворами кислот и солей? Почему сельскохозяйственную технику (тракторы, комбайны) не рекомендуется хранить под открытым небом? Цель работы: закрепление, совершенствование и углубление знаний и умений учащихся по электролизу. Опыт 2. Электролиз раствора хлорида натрия. Соедините провода с полюсами батарейки от карманного фонаря. Провод-анод вставьте в свежий срез клубня картофеля (среда, в которой распределяется раствор соли). Провод-катод с укрепленными на нем гвоздиком также вставьте в срез картофеля на расстоянии 1,5-2 см от первого электрода. На срез картофеля нанесите3-4 капли раствора хлорида натрия. У гвоздика поместите маленький кусочек фенолфталеиновой бумажки (рис.3). В таком положении оставьте установку на 15-20 минут. Какие происходят изменения на срезе картофеля? Чем объяснить эти изменения? Напишите уравнение реакции.
Рис.3. Электролиз раствора хлорида натрия: 1 – раствор хлорида натрия; 2 – фенолфталеиновая бумажка. Опыт 3. Электролиз раствора хлорида натрия с применением бумажной диафрагмы.
В сосуд налейте раствор поваренной соли и разгородите сосуд бумажной перегородкой. Соедините графитовые стержни карандаша проводами с батарейкой. В катодное пространство опустите кусочек фенолфталеиновой бумажки (рис.4) и наблюдайте за происходящими изменениями. Как изменяется окраска жидкости в катодном пространстве? Какой газ выделяется па поверхности катода? Определите по запаху выделяющийся у анода газ. Напишите уравнение реакции. Рис.4. Электролиз раствора хлорида натрия с применением бумажной диафрагмы: 1 – стержни от карандаша; 2 – бумажная перегородка; 3 – раствор хлорида натрия; 4 – раствор фенолфталеина. Опыт 4. Электролиз раствора хлорида натрия с применением пористой перегородки. В стакане приготовьте 70-80 ìë раствора хлорида натрия. Тщательно вымойте яичную скорлупу, заполните ее на 3/4 раствором и опустите осторожно в стакан. В стакан и скорлупу на поверхности растворов опустите по кусочку фенолфталеиновой бумажки. Соедините графитовые стержни с проводами. Один стержень опустите в яйцо, второй - в стакан. Электроды (стержни с проводами) соедините с батарейкой (рис.5). Оставьте в таком положении установку на 35-40 мин. Раствор какого вещества образуется внутри скорлупы? Что образуется в анодном пространстве? Напишите уравнение реакции.
Рис.5. Электролиз раствора хлорида натрия с применением пористой перегородки: 1 – графитовые стержни; 2 – раствор хлорида натрия; 3 – раствор фенолфталеина. Напишите уравнение реакции. Опыт 5. Электролиз раствора хлорида натрия
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 173; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.012 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||