Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 1 Общая характеристика токсикантаСодержание книги
Поиск на нашем сайте
КУРСОВАЯ РАБОТА Тема: Исследование аварийной экотоксикологической ситуации и меры по ее устранению (хром).
Выполнил: Зайцев С.Е. 4курс 1 гр. Проверил: Ткаченко М.Н.
Лесниково 2008 ОГЛАВЛЕНИЕ
Введение Глава 1 Общая характеристика токсиканта. Нахождение в природе Происхождение Получение Физические свойства Химические свойства Глава 2 Гигиенические параметры токсикантов Глава 3 Подходы к отбору проб Порядок отбора проб пищевых продуктов Определение тяжелых металлов в почвах сельскохозяйственных угодий, продукции растениеводства и кормах Отбор проб почвы и растений при общих и локальных загрязнениях Глава 4 Аналитические методы определения токсиканта в образцах Критерии оценки методов определения остатков токсических веществ Глава 5 Выбор вида индикатора Глава 6 Токсикологические методы оценки воздействия присутствующей дозы токсиканта на компоненты биоты Выводы и предложения Список литературы ВВЕДЕНИЕ К группе тяжелых металлов относят, за исключением благородных и редких, те из металлов, которые имеют плотность более 8 тыс.кг/м3. (свинец, медь, цинк, никель, кадмий, кобальт, сурьму, висмут, ртуть, олово, ванадий, полуметалл мышьяк и др.). Многие из них широко распространены в окружающей среде и способны вызывать заболевания у людей. Один из наименее токсичных тяжелых металлов – Хром. В растительных и животных организмах хром всегда присутствует в составе ДНК. Некоторые виды млекопитающих способны переносить увеличение содержание этого элемента в организме в сотни раз без видимых негативных последствий. Большинство микроорганизмов, многие виды лекарственных растений способны аккумулировать хром. В трехвалентном состоянии хром распространен повсеместно. Экотоксический эффект имеет шестивалентный хром, которые крайне редко встречается в природных условиях и, как правило, появляется в результате антропогенной активности (использование хрома, сжигание угля, добыча руды и производство металла). Токсичность шестивалентного хрома проявляется в подавлении роста, в торможении метаболических процессов, в виде генотоксического, эмбриотоксического и тератогенного эффектов. При воздействии на людей выделяют легочную и желудочную формы интоксикации. Отмечаются различные дерматиты, аллергические реакции, раздражение верхних дыхательных путей. Многочисленными эпидемиологическими исследованиями установлено, что хроматы могут вызывать бронхогенный рак, поэтому хром и его соединения относят к группе высокого канцерогенного риска для человека. ГЛАВА 1 ОБЩАЯ ХАРАКТЕРИСТИКА ТОКСИКАНТА НАХОЖДЕНИЕ В ПРИРОДЕ
Хром встречается ввиде соединений в различных минералах. Наиболее распространен минерал хромит, или хромистый железняк FeCr2О4, богатые месторождения которого имеются на Урале и в Казахстане. Массовая доля хрома в земной коре составляет 0,03%. Хром обнаружен на Солнце, звездах и в метеоритах. Еще в 1766 году петербургский профессор химии И. Г. Леман описал новый минерал, найденный на Урале на Березовском руднике, в 15 километрах от Екатеринбурга (ныне Свердловск). Обрабатывая камень соляной кислотой, Леман получил изумрудно-зеленый раствор, а в образовавшемся белом осадке обнаружил свинец. Спустя несколько лет, в 1770 году, Березовские рудники описал академик П. С. Паллас. «Березовские копи, – писал он, – состоят из четырех рудников, которые разрабатываются с 1752 года. В них наряду с золотом добываются серебро и свинцовые руды, а также находят замечательный красный свинцовый минерал, который не был обнаружен больше ни в одном другом руднике России. Эта свинцовая руда бывает разного цвета (иногда похожего на цвет киновари), тяжелая и полупрозрачная... Иногда маленькие неправильные пирамидки этого минерала бывают вкраплены в кварц подобно маленьким рубинам. При размельчении в порошок она дает красивую желтую краску...». В 1936 году в Казахстане, в районе Актюбинска, были найдены огромные залежи хромита – основного промышленного сырья для производства феррохрома. В годы войны на базе этого месторождения был построен Актюбинский ферросплавный завод, который впоследствии стал крупнейшим предприятием по выпуску феррохрома и хрома всех марок. Богат хромистой рудой и Урал. Здесь расположено большое число месторождений этого металла: Сарановское, Верблюжьегорское, Алапаевское, Монетная дача, Халиловское и др. По разведанным запасам хромистых руд Россия занимает ведущее место в мире. Руды хрома имеются в Турции, Индии, Новой Каледонии, на Кубе, в Греции, Югославии, некоторых странах Африки. В то же время такие промышленные страны, как Англия, Франция, ФРГ, Италия, Швеция, Норвегия, совершенно лишены хромового сырья, а США и Канада располагают лишь очень бедными рудами, практически не пригодными для производства феррохрома. Всего же на долю хрома приходится 0,02% земной коры. Происхождение
Найденный минерал был назван «сибирским красным свинцом». Впоследствии за ним закрепилось название «крокоит». Образец этого минерала был в конце XVIII века привезен Палласом в Париж. Крокоитом заинтересовался известный французский химик Луи Никола Воклен. В 1796 году он подверг минерал химическому анализу. «Все образцы этого вещества, которые имеются в нескольких минералогических кабинетах Европы, – писал Воклен в своем отчете, – были получены из этого (т. е. Березовского С. В.) золотого рудника. Раньше рудник был очень богат этим минералом, однако говорят, что несколько лет назад запасы минерала в руднике истощились и теперь этот минерал покупают на вес золота, в особенности, если он желтый. Образцы минерала, не имеющие правильных очертаний или расколотые на кусочки, годятся для использования их в живописи, где они ценятся за свою желто-оранжевую окраску, не изменяющуюся на воздухе... Красивый красный цвет, прозрачность и кристаллическая форма сибирского красного минерала заставила минералогов заинтересоваться его природой и местом, где он был найден; большой удельный вес и сопутствующая ему свинцовая руда, естественно, заставляли предполагать о наличии свинца в этом минерале...». Один из друзей Воклена предложил ему назвать элемент хромом (по-гречески «хрома» – окраска) из–за яркого разнообразного цвета его соединений. Между прочим, слог «хром» в значении «окрашенный» входит во многие термины, не связанные с элементом хромом: слово «хромосома», например, в переводе с греческого означает «тело, которое окрашивается»; для получения цветного, изображения пользуются прибором хромоскопом; фотолюбителям хорошо известны пленки «изопанхром», «панхром», «ортохром»; яркие образования в атмосфере Солнца астрофизики называют хромосферными вспышками и т. д. Сначала Воклену не понравилось предложенное название, поскольку открытый им металл имел скромную серую окраску и как будто не оправдывал своего имени. Но друзья все же сумели уговорить Воклена и, после того как французская Академия наук по всей форме зарегистрировала его открытие, химики всего мира внесли слово «хром» в списки известных науке элементов. Свое название хром получил от греческого слова «хрома» — краска за то, что все соединения хрома имеют яркие окраски. Получение
Металлический хром получают восстановлением оксида хрома (III) при нагревании с алюминием:
Сr2О3 + 2Аl = Аl2О3 +2Сr
Металлический хром получают также электролизом водных растворов соединений хрома. В 1797 году Воклен повторил анализ. Растертый в порошок крокоит он поместил в раствор углекислого калия и прокипятил. В результате опыта ученый получил углекислый свинец и желтый раствор, в котором содержалась калиевая соль неизвестной тогда кислоты. При добавлении к раствору ртутной соли образовывался красный осадок, после реакции со свинцовой солью появлялся желтый осадок, а введение хлористого олова окрашивало раствор в зеленый цвет. После осаждения соляной кислотой свинца Воклен выпарил фильтрат, а выделившиеся красные кристаллы (это был хромовый ангидрид) смешал с углем, поместил в графитовый тигель и нагрел до высокой температуры. Когда опыт был закончен, ученый обнаружил в тигле множество серых сросшихся металлических иголок, весивших в 3 раза меньше, чем исходное вещество. Так впервые был выделен новый элемент. Основная часть добываемой в мире хромистой руды поступает сегодня на ферросплавные заводы, где выплавляются различные сорта феррохрома и металлического хрома. Впервые феррохром был получен в 1820 году восстановлением смеси окислов железа и хрома древесным углем в тигле. В 1854 году удалось получить чистый металлический хром электролизом водных растворов хлорида хрома. К этому же времени относятся и первые попытки выплавить углеродистый феррохром в доменной печи. В 1865 году был выдан первый патент на хромистую сталь. Потребность в феррохроме начала резко расти. Важную роль в развитии производства феррохрома сыграл электрический ток, точнее электротермический способ получения металлов и сплавов. В 1893 году французский ученый Муассан выплавил в электропечи углеродистый феррохром, содержащий 60% хрома и 6% углерода. В дореволюционной России ферросплавное производство развивалось черепашьими темпами. Мизерные количества ферросилиция и ферромарганца выплавляли доменные печи южных заводов. В 1910 году на берегу реки Сатки (Южный Урал) был построен маленький электрометаллургический завод «Пороги», который стал производить феррохром, а затем и ферросилиций. Но об удовлетворении нужд своей промышленности не могло быть и речи: потребность России в ферросплавах приходилось почти полностью покрывать ввозом их из других стран.
Физические свойства
Хром — серовато-белый блестящий металл по внешнему виду похож на сталь. Из металлов он самый твердый, его плотность 7,19 г/см3, т. пл. 1855 °С. Природный хром состоит из смеси пяти изотопов с массовыми числами 50, 52, 53, 54 и 56. Радиоактивные изотопы получены искусственно. Хром обладает всеми характерными свойствами металлов — хорошо проводит тепло, почти не оказывает сопротивления электрическому току, имеет присущий большинству металлов блеск. Любопытна одна особенность хрома: при температуре около 37°С он ведет себя явно «вызывающе» — многие его физические свойства резко, скачкообразно меняются. В этой температурной точке внутреннее трение хрома достигает максимума, а модуль упругости падает до минимальных значений. Так же внезапно изменяются электропроводность, коэффициент линейного расширения, термоэлектродвижущая сила. Пока ученые не могут объяснить эту аномалию. Даже незначительные примеси делают хром очень хрупким, поэтому в качестве конструкционного материала его практически не применяют, зато как легирующий элемент он издавна пользуется у металлургов почетом. Небольшие добавки его придают стали твердость и износостойкость. Такие свойства присущи шарикоподшипниковой стали, в состав которой, наряду с хромом (до 1,5%), входит углерод (около 1%). Образующиеся в ней карбиды хрома отличаются исключительной твердостью — они-то и позволяют металлу уверенно сопротивляться одному из опаснейших врагов — износу. В качестве представителя металлов, относящихся к побочным подгруппам периодической системы, рассмотрим хром: он возглавляет побочную подгруппу VI группы. Хром — металл, по внешнему виду похожий на сталь. От ранее рассмотренных металлов он, как и все металлы с достраивающимся предпоследним электронным слоем атома, отличается тугоплавкостью и твердостью. По твердости хром превосходит все металлы, он царапает стекло. Химические свойства
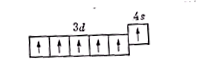
Расположение электронов на 3d- и 4s-орбиталях атома хрома можно представить схемой: Отсюда видно, что хром может проявлять в соединениях различные степени окисления — от +1 до +6; из них наиболее устойчивы соединения хрома со степенями окисления +2, +3, +6. Таким образом, в образовании химических связей участвует не только электрон внешнего уровня, но и пять электронов d-подуровня второго снаружи уровня. Как и у алюминия, на поверхности хрома образуется оксидная пленка Сr2О3. Поэтому хром в разбавленных серной и соляной кислотах начинает растворяться не сразу, а после растворения оксидной пленки:
Cr + 2H+=Cr5+ + H2
В азотной и концентрированной серной кислотах хром не растворяется, так как его оксидная пленка упрочняется, т. е. хром переходит в пассивное состояние. По этой же причине не взаимодействуют с хромом разбавленные серная и соляная кислоты, содержащие растворенный кислород. Пассивацию хрома можно устранить очисткой поверхности металла. При высокой температуре хром горит в кислороде, образуя оксид Cr2О3. Раскаленный хром реагирует с парами воды: 2Cr + ЗН2О = Cr2О3 + ЗН2
Металлический хром при нагревании реагирует также с галогенами, галогеноводородами, серой, азотом, фосфором, углем, кремнием и бором. Например:
Cr + 2HF = CrF2 + H2 ; 2Cr + N2 = 2CrN 2Cr + 3S = Cr2S3; Cr + Si = CrSi
На воздухе хром совершенно не изменяется. Поэтому хромом с помощью электролиза его соединений покрывают — хромируют — стальные изделия для предохранения их от ржавления и механического износа. Эти же качества хром придает своим сплавам с железом — хромистым сталям. К ним относится нержавеющая сталь, содержащая около 12% хрома. В быт нержавеющая сталь вошла в виде вилок, ножей и других предметов домашнего обихода. Блестящие, серебристого цвета полосы нержавеющей стали украшают арки станции «Маяковская» Московского метрополитена. При химических реакциях атом хрома может отдавать, кроме единственного электрона наружного слоя, до 5 электронов предпоследнего слоя, т. е. проявлять высшую степень окисления (+6). Но, как и все элементы с достраивающимся предпоследним слоем атома, хром проявляет несколько значений степеней окисления, т. е. кроме высшего и низшие значения, а именно + 2 и + 3. ГЛАВА 4 АНАЛИТИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ ТОКСИКАНТА В ОБРАЗЦАХ В настоящее время для анализа остатков химических веществ в объектах окружающей среды и биологическом материале используют современные физико-химические методы, такие, как тонкослойную и газожидкостную хроматографию, ультрафиолетовую инфракрасную и атомно-абсорбционную спектрометрию, масс-спектрометрию и хромас-спектрометрию. Современные методы исследования должны быть по возможностиспецифичными, т. е. позволяли бы открывать искомое вещество в присутствии других аналогичных соединений, быть достаточно чувствительными и позволяли бы определять миллионные доли вещества в 1 кг субстрата. Особенно это важно для методов, предназначенных для санитарной оценки кормов и продуктов животноводства, а также для изучения динамики остатков пестицидов в воде, растениях и организме животных.Степень определения химических токсикантов должна составлять не менее 60 % от количества стандартного вещества, внесенного в пробу. Методы должны быть удовлетворительно точными (не менее ±20 %) и хорошо воспроизводимыми. Методы определения токсических веществ в патологическом материале, объектах окружающей среды, кормах и продуктах питания животного происхождения включают в себя выделение токсического вещества из пробы. Выделение яда из пробы может быть проведено путем мокрого или сухого озоления, отгонки с водяным паром или же экстракцией одним или несколькими органическими растворителями. Сухое озоление проводят под действием высоких температур (до 500°С) в муфельной печи. Этот метод в основном используют для выделения металлов. Мокрое озоление применяют значительно чаще и проводят при помощи концентрированных неорганических кислот, чаще всего смеси азотной, серной кислот и окислителей. Выделение токсических веществ методом отгонки с водяным паром или дистилляции используют для легколетучих химических соединений. Сущность метода заключается в том, что пробу тщательно измельчают до кашицеобразного состояния или же разрушают неорганической кислотой, разбавляют водой, а затем воду перегоняют, нагревая колбу или подавая в нее пар от парообразователя. Токсические вещества переводятся в дистиллят. Чаще других в ветеринарной практике выделяют токсические вещества путем их экстракции из пробы органическими растворителями. Для этого пробу тщательно измельчают, помещают в колбу,а затем заливают одним или несколькими органическими растворителями. Объем органического растворителя должен быть не менее чем в 2 раза больше массы или объема пробы. Экстракцию токсиканта проводят путем выдерживания пробы с органическим растворителем в течение 20–24 ч, перемешивания на шюттель-аппарате в течение 1–2 ч или смешивания в течение нескольких минут при большой скорости вращения перемешивающего устройства (ультратораксы, омнимиксары и др.). Последний способ предпочтителен, так как при этом образуется гомогенная масса, в которой создается наиболее тесный контакт органического растворителя с субстратом, а следовательно, наиболее полно извлекаются токсические вещества, содержащиеся в пробе. Для этой цели также используют аппарат Соксклета, в котором токсическое вещество экстрагируется при многократном промывании субстрата кипящим органическим растворителем. Аппарат Соксклета обеспечивает более полное извлечение токсиканта из пробы по сравнению с другими методами. При любом способе выделения токсического вещества в экстракт переходит значительное количество примесей, мешающих распределению: жиры, пигменты, воск, белки, соли и др. Для освобождения экстракта от этих веществ используют различные способы очистки: путем омыления, вымораживания, осаждения, перераспределения из одного органического растворителя в другой с помощью специальных колонок и др. Последние зависят от вида анализируемого соединения и субстрата, в котором он находится. Для того чтобы повысить чувствительность метода анализа, экстракты концентрируют до небольшого объема, достаточного для проведения исследований данным методом. Обычно конечные объемы экстрактов составляют 0,5–5мл. Для концентрирования используют специальные аппараты Кудерна–Данича, вакуум-ротационные испарители. Концентрирование также можно проводить в токе воздуха или азота. В практических условиях наиболее приемлемым способом является концентрирование в токе воздуха. Для этого экстракт заливают в фарфоровую выпарительную чашку, ставят ее под шторку вытяжного шкафа и включают тягу. При определении высоколетучих веществ при концентрировании возможнызначительные потери яда, поэтому при этой операции необходимо выполнять следующие требования: не концентрировать конечные экстракты при повышенной (выше 40°С) температуре, не упаривать досуха очищенные экстракты. Индикацию токсических веществ проводят следующими физико-химическим методами. Тонкослойную хроматографиюнаиболее широко применяют в практических лабораториях. Принцип полуколичественного метода состоит в том, что смесь химических веществ, содержащихся в анализируемой пробе, наносят на пластинку и разделяют в тонком слое инертного порошка (селикагель, окись алюминия и др.) с помощью смеси органических растворителей (подвижный растворитель). Пластинку опрыскивают раствором проявляющего реактива, в результате чего на ней появляются в виде окрашенных пятен исследуемые химические соединения. Идентифицируют открытые вещества по величине Rf– частному от деления расстояния, пройденного искомым веществом от точки нанесения (линия старта) до места дислокации, к расстоянию, пройденному подвижным растворителем. Количество открываемого вещества определяют по интенсивности окраски пятна и его размерам. В практике ветеринарных химико-токсикологических исследований тонкослойная хроматография используется для определения многих пестицидов, алкалоидов, микотоксинов, органических соединений тяжелых металлов. Метод прост по технике использования, не требует сложного оборудования, обладает достаточно высокой специфичностью и чувствительностью (0,05–1,0 мкг в пробе). Атомно-абсорбционная спектрометрияоснована на поглощении отдельными атомами химических элементов световых лучей в определенной области спектра. Поэтому исследуемые химические вещества вначале минерализуются, а затем в состоянии раствора подвергаются воздействию лучами определенной длины, соответствующей поглощающей способности того или иного элемента. По степени поглощения лучей определяют его количественное содержание. Этот метод находит широкое применение главным образом при определении металлов и металлоидов (ртуть, свинец, кадмий, медь, цинк и др.). Нейтронно-активационный анализоснован на облучении пробы нейтронами, в результате чего возникает наведенная радиация, по степени которой и определяют количественный уровень содержания исследуемого элемента. Однако метод требует сложного оборудования, поэтому малоприемлем в практических условиях. Критерии оценки методов определения остатков токсических веществ Методы определения остатков токсических веществ в объектах обычно характеризуют по чувствительности, точности и определяемости. Чувствительность метода– наименьшее количество химического вещества, открываемое при заданных условиях метода. Она может быть абсолютной и относительной. Абсолютная чувствительность – наименьшее количество вещества, которое можно определить данным методом или реакцией, лежащей в ее основе. Так, с помощью жидкостной хроматографии можно определить 0,05 нг ТХМ-3. Однако для исследования используют лишь часть аликвоты, предназначенной для анализа, которая соответствует определенной части пробы. Поэтому для полной характеристики метода целесообразно ввести такое понятие, как относительная чувствительность – чувствительность по отношению к одному и тому же объему или массе. Обычно относительную чувствительность принято выражать в мг/кг пробы. Точность метода. Под точностью метода, как правило, понимают различие между истинной и экспериментальной величиной. При этом за истинную величину может быть принято количество вещества, вносимого в пробу из стандартного раствора. Поэтому точность метода может быть охарактеризована как разница между количеством вещества, внесенного в пробу и определенного данным методом аналитического исследования. Точность– это величина стандартного относительного отклонения, установленного по результатам воспроизведения методики при внесении данного количества вещества в пробу. Точность метода соответствует величине стандартного относительного отклонения и вычисляется по формуле
σ(стандартное отклонение)= ∑(X - X) 2 N-1
где N– число измерений; X– примерная величина; Х– среднее арифметическое; ∑ – знак суммирования. Сначала рассчитывают среднее арифметическое, затем абсолютную величину разности между средним арифметическим и значением отдельного измерения; разность возводят в квадрат и эту величину суммируют. Сумму делят на N-1. Квадратный корень из полученного результата представляет собой стандартное отклонение σ. Однако точность метода может быть вычислена применительно к определяемости. Поэтому сначала устанавливают определяемость метода, а затем его точность по показателю относительного стандартного отклонения. Определяемость метода – средняя величина, показывающая процент открытия вещества в пробе после его внесения из стандартного раствора в количествах, соответствующих пределу определения и максимально возможному уровню содержания. (Жуленко с соавторами, 2002) ВЫВОДЫ И ПРЕДЛОЖЕНИЯ Неконтролируемое загрязнение окружающей среды тяжелыми металлами угрожает здоровью людей. В связи с этим необходимо максимально снизить уровень поступления тяжелых металлов в организм человека. В частности, путем получения продукции растениеводства (пищи для человека и сельскохозяйственных животных, которые в свою очередь также являются источником продуктов питания для человека) свободной от загрязнения тяжелыми металлами. Следовательно, необходимо проводить химический анализ почв на содержание каждого из наиболее опасных металлов. В Нидерландах разработана нормативная база концентрации тяжелых металлов. Установлено три уровня содержания их в почве: А – фоновые концентрации; В – концентрации, указывающие на необходимость проведения дополнительных исследований и мероприятий; С – пороговые концентрации, свидетельствующие о необходимости проведения срочных мер по очистке почв. В таблице 4 представлены уровни содержания тяжелых металлов в почве:
Таблица 4 Уровни содержания тяжелых металлов в почве Металл | Концентрация (мг/кг) | |||||||||||
| Фоновая (А) | Повышенная (В) | Пороговая (С) | |||||||||||
| Хром | 100 | 250 | 800 | ||||||||||
| Кобальт | 20 | 50 | 300 | ||||||||||
| Никель | 50 | 100 | 500 | ||||||||||
| Медь | 50 | 100 | 500 | ||||||||||
| Цинк | 200 | 500 | 3000 | ||||||||||
| Молибден | 10 | 40 | 500 | ||||||||||
| Кадмий | 1 | 5 | 20 | ||||||||||
| Олово | 20 | 50 | 300 | ||||||||||
| Барий | 200 | 400 | 2000 | ||||||||||
| Ртуть | 0,3 | 2 | 10 | ||||||||||
| свинец | 50 | 150 | 600 | ||||||||||
Для получения продукции растениеводства, свободной от тяжелых металлов, на почвах с повышенным их содержанием необходимо:
§ провести агрохимическое обследование пашни, определить содержание тяжелых металлов в почве
§ сопоставить содержание тяжелых металлов с содержанием калия и кальция
§ произвестковать кислые почвы
§ повысить содержание обменного калия в почве
§ исключить применение минеральных удобрений, содержащих тяжелые металлы
§ подобрать культуры, минимально потребляющие эти элементы; на сильно загрязненных полях можно выращивать культуры для технической переработки
§ периодически проводить контроль продукции на содержание тяжелых металлов
Кроме того, снизить воздействие тяжелых металлов на здоровье населения можно путем решения следующих задач:
1. организация точного и оперативного контроля выбросов тяжелых металлов в атмосферу и воду;
2. прослеживание цепей миграции тяжелых металлов от источников до человека;
3. налаживание широкого и действенного контроля (на различных уровнях, вплоть до бытового) содержания тяжелых металлов в продуктах питания, воде и напитках.
4. проведение выборочных, а затем и массовых обследований населения на содержание тяжелых металлов в организме.
Подобные меры применяются в ряде развитых стран. В США реализуется национальная программа массовых обследования детей на содержание свинца в крови, государством финансируются разработки необходимых технических средств.
Сложности решения указанных задач состоят в том, что 1) миграция и токсичность элементов зависят от физико-физических форм, поэтому методы анализа должны давать возможность определять связанные и лабильные формы вещества, степень окисления элементов; 2) средства контроля должны обладать низким порогом обнаружения, высокой селективностью и низкой стоимостью.
Наиболее сложной и слабо изученной проблемой является медико-санитарное нормирование воздействия элементов на жизнедеятельность. ПДК и другие нормы выведены эмпирически, при отсутствии общей теории вопроса. Они не учитывают даже главные особенности химизма природных и техногенных систем, для которых предназначены, и не всегда привязаны к определенным соединениям или формам нахождения элементов.
Не решены вопросы суммарного влияния нескольких элементов – эффектов их антагонистического (снижающегося) или синергетического (увеличивающегося) взаимодействия. Эта проблема наиболее остра, так как обычно в экогеохимических системах присутствуют ассоциации большого числа элементов.
СПИСОК ЛИТЕРАТУРЫ
1. Волков Ю. В. Мониторинг окружающей среды с помощью годичных колец деревьев // Проблемы геологии и освоения недр/ Тез. Докл. V Международный научный симпозиум имени академика М.А. Усова студентов, аспирантов и молодых ученых, посвященный 100-летию горно ― геологического образования в Сибири, 9 ― 13 апр., 2001 ― Томск, ― С. 597 ― 598.
2. Государственный доклад о состоянии окружающей природной среды Российской Федерации в 1998 году.: М, ― 1999. ― 265 с.
3. Дмитриева С.А., Парфенов В.И. Кариология флоры как основа цитогенетического мониторинга: на примере Березовского биосферного заповедника. ― Минск: Наука и техника. ― 1991. ― 231с
4. Евгеньев М.И. Тест ― методы и экология // Соросовский образовательный журнал. ― 1999. ― № 11. ― С.29 ― 34.
5. Евсеева Т. И., Гераськин С.А. Использование традесканции для оценки токсичности, тератогенности и мутагенности проб талой воды, содержащих тяжелые металлы // Международный экологический конгресс "Новое в экологии и безопасности жизнедеятельности", Санкт ― Петербург, 14 ― 16 июня, 2000. СПб, 2000 ― Т. 2. С. 178 ― 181
6. Егоров Д.О., Егорова А.О Оценка уровня загрязненности окружающей среды с использованием биоиндикаторов // "Современные проблемы
экологии, микробиологии и иммунологии" Тез. докл. регион. Конференции молодых ученых, 18 ― 20 янв., 1999. ― Пермь, ― С. 25 ― 27
7. Егоров Ю. А., Николаевский В. С., Суздалева А. Л. Место биоиндикации в системе обеспечения экологической безопасности человеческой деятельности: На примере атомной энергетики // Современные проблемы
биоиндикации и биомониторинга" Тез. Докл. Международн. симпозиума по биоиндикаторам 17 ― 21 сент., 2001. ― Сыктывкар, 2001 ― С. 58, 246
8. Егорова Е.И., Козьмин Г.В., Трофимов А.И. Проблемы экологической оценки состояния природной среды в районах размещения атомных электростанций // Вестник Российской Академии Естественных Наук. ― 2002. ― №2. ― С. 4 ― 8.
9. Егорова Е.И., Сынзыныс Б.И. Биотестирование объектов окружающей среды. Лабораторный практикум по курсу «Биотестирование». ― Обнинск: ИАТЭ, 1997. ― 88с
10. Жуленко В.Н., Рабинович М.И., Таланов Г.А. Ветеринарная токсикология. –– М.: Колос, 2002. – 384с.
11. Илющенко В.П., Щегольков В.Н. Чувствительность Allium ― теста к присутствию тяжелых металлов в водной среде // Химия и технология воды. ― 1990. ― Т. 12. ― №3. ― С. 275 ― 278
12. Колупаев В. Б. Парамеции и черви как индикаторы загрязнения почв городских территорий // Международная научная конференция" Экологические и гидрометеорологические проблемы больших городов и промышленных зон"., Санкт ― Петербург, 18 ― 20 окт., 2000. СПб, 2000 ― С. 73 ― 74.
13. Криволуцкий Д.А. Биоиндикация экологических последствий аварии на ЧАЭС // Биотестирование в решении экологических проблем. Зоол. Ин ― т РАН. С ― Пб, 1991. ― С.27 ― 118
14. Методические указания по определению тяжелых металлов в почвах сельхозугодий и продуктов растениеводства. Утв. Минсельхозом РФ 10.03.1992
15. Методы биотестирования качества водной среды: Сб.ст./Под ред. О.Ф. Филенко. М., 1989. 132 с.
16. Михайлуц А. П., Зайцев В. И., Галенда И. Л. Биотестирование объектов окружающей среды и биоиндикация в городе с развитой химической
промышленностью // Вестн. Рос. акад. естеств. наук. Зап. ― Сиб. Отд-ние, 2001. ―. № 4. ― C. 82 ― 91, 203 ― 204.
17. Морозова О.Г., Бабаева Н.Н., Морозов С.В., Репях С.М. Влияние затопленных растительных остатков на формирование гидрохимического режима водоема ― охладителя Березовской ГРЭС ― 1.3. Оценка
токсичности воды методом биотестирования // Химия растительного сырья, 2001. ― №1. ― С. 89 ― 92
18. Нечаев А.П., Траубенберг С.Е., Кочеткова А.А. Учебник для студентов вузов, обучающихся по направлениям: «Технология продуктов питания»// –– СПб.: ГИОРД, 2003. –– 640 с.
19. Оливернусова Л. Оценка состояния окружающей среды методом комплексной биоиндикации. // Биоиндикация и биомониторинг. ― М:
Наука. ― 1991
20. Патин С.А. Биотестирование, как метод изучения и предотвращения загрязнения водоемов // Биотестирование природных и сточных вод. М.: Наука, 1981. ― С.7 ― 16.
21. Петухова Г.А., Доронина С.А Оценка опасности эффектов последействия нефти и продуктов нефтедобычи с помощью модельных тест ― объектов // Научные проблемы Западно ― Сибирского нефтегазового региона:
гуманитарные, естественные и технические аспекты: научно ― техническая конференция, Тюмень, 14 ― 17 дек., 1999. Тезисы докладов. Тюмень, 1999
― С.298 ― 299
22. Правила охраны поверхностных вод. Типовые положения. М.: Изд. Госкомприроды СССР. 1991. 38 с
23. Тарасенко И.Н. К вопросу о биотестировании // Экология и охрана окружающей среды. ― 1999. ― № 5. ― С. 563
24. Федорова А. И. Биоиндикация загрязнения городской среды // Изв. РАН. Сер. геогр. ― 2002. ― № 1. ― С. 72 ― 80
25. Христова М.В., Безруков М.Е. Характеристика токсикологической активности триэтиларсина в системе трофических взаимодействий «хищник ― жертва» // Экология и охрана окружающей среды. ― 1994. ― № 5. ― С.
55 ― 64
26. Шеуджен А.Х. Биогеохимия // Майкоп: ГУРИПП «Адыгея», 2003. –– 1028 с
27. Rathinam K., Mohanan P.V. Micritox system, a new approach to the safety evaluation of medical devices // Biomater. Appl. ― 1996. ― 13 (2). ― P. 166 ― 171.
28. Richardson M. Ecitoxity monitoring use of Vibrio fisheri // Arh Hig Rada Toxicol. ― 1996. ― 47(4). ― P. 389 ― 396.
29. http://www.edu.yar.ru/russian/pedbank/sor_uch/chem/proskur/, Разработка химического эксперимента с экологическим содержанием, Проскурина И.К. 30. http://www.iemrams.spb.ru/russian/ecologru/ecotoxic.htm, Экотоксиканты, Институт экспериментальной медицины РАМН, Санкт- Петербург.
31. http://n-t.ru/ri/ps/pb024.htm, Популярная библиотека химических элементов, Хром.
КУРСОВАЯ РАБОТА
Тема: Исследование аварийной экотоксикологической ситуации и меры по ее устранению (хром).
Выполнил:
Зайцев С.Е. 4курс 1 гр.
Проверил:
Ткаченко М.Н.
Лесниково 2008
ОГЛАВЛЕНИЕ
Введение
Глава 1 Общая характеристика токсиканта. Нахождение в природе
Происхождение
Получение
Физические свойства
Химические свойства
Глава 2 Гигиенические параметры токсикантов
Глава 3 Подходы к отбору проб
Порядок отбора проб пищевых продуктов
Определение тяжелых металлов в почвах сельскохозяйственных угодий, продукции растениеводства и кормах
Отбор проб почвы и растений при общих и локальных загрязнениях
Глава 4 Аналитические методы определения токсиканта в образцах
Критерии оценки методов определения остатков токсических веществ
Глава 5 Выбор вида индикатора
Глава 6 Токсикологические методы оценки воздействия присутствующей дозы токсиканта на компоненты биоты
Выводы и предложения
Список литературы
ВВЕДЕНИЕ
К группе тяжелых металлов относят, за исключением благородных и редких, те из металлов, которые имеют плотность более 8 тыс.кг/м3. (свинец, медь, цинк, никель, кадмий, кобальт, сурьму, висмут, ртуть, олово, ванадий, полуметалл мышьяк и др.). Многие из них широко распространены в окружающей среде и способны вызывать заболевания у людей.
Один из наименее токсичных тяжелых металлов – Хром. В растительных и животных организмах хром всегда присутствует в составе ДНК. Некоторые виды млекопитающих способны переносить увеличение содер
|
| Поделиться: |