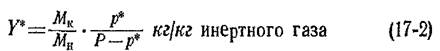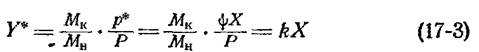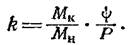Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесие между фазами (Статика процесса абсорбции)
Равновесие между фазами определяется правилом фаз Гиббса: число параметров (или степеней свободы) С процесса равно числу компонентов К минус число фаз Ф плюс 2: С = К – Ф + 2 Правило фаз представляет собой наиболее широкое обобщение условий гетерогенного равновесия. 3 Процесс абсорбции осуществляется в двухфазной системе (газ-жидкость) трёхкомпонентной (хотя бы один целевой компонент в газовой смеси, инертный газ, жидкий поглотитель) системе. Согласно правилу фаз число степеней свободы этой системы равно 3 (С = К – Ф + 2 =3 – 2 + 2 = 3). Следовательно, не нарушая равновесия в системе, можно варьировать тремя её параметрами (температурой, давлением, и составом одной из фаз). В двухфазных системах газ- жидкость равновесие обычно выражается в виде фазовых диаграмм: - состав – состав или - состав – свойство. Например, состав – давление или состав – температура кипения. Для абсорбционно-десорбционных процессов равновесие между газами и их растворами в жидкости описывается законом Генри, по которому при данной температуре количество газа, растворяющегося в жидкости, прямо пропорционально давлению газа над ней: р * = Кх, где р * - равновесное парциальное давление растворённого газа; х – содержание растворённого газа в жидкости (в мольных долях или кг/кг поглотителя); К – константа Генри, зависящая от свойств растворённого газа и поглотителя, а также от температуры, имеет размерность давления. Растворимость многих газов значительно отклоняется от закона Генри. Это относится главным образом к хорошо растворимым газам, образующим растворы высокой концентрации. Закон Генри хорошо согласуется с опытом для слабо растворимых газов, а также для низких концентраций хорошо растворимых газов. Для них фактическая растворимость при высоких концентрациях оказывается ниже, чем это следует из закона Генри. Растворимость газов в жидкостях зависит от - свойств газа и жидкости, - от температуры, - парциального давления растворяющегося газа (компонента) в газовой смеси. Зависимость между растворимостью газа и его парциальным давлением характеризуется законом Генри, согласно которому равновесное парциальное давление р * пропорционально содержанию растворенного газа в растворе X (в кг/кг поглотителя):
где φ – коэффициент пропорциональности имеющий размерность давления и зависящий от свойств растворённого газа и поглотителя и от температуры (Пл. Приложение XVI) 4 Для практических расчетов пользуются полученными из опыта значениями равновесного парциального давления газа р* и вычисляют равновесное содержание абсорбируемого компонента в газовой смеси У* по уравнению Рауля-Дальтона у* = (р/П)х, где р – давление паров чистого компонента, определяемое по закону Рауля, как р =р*/х; П – общее давление газовой смеси. Т.о. у* = (р/П)х = m х, т.е уравнение равновесия при небольших по сравнению с р значениях р*) для процесса абсорбции при низкоконцентрированных растворах газов представляет собой уравнение прямой линии у* = m х с тангенсом наклона, равным m, причём отношение постоянных величин m = К/П – коэффициент распределения, постоянный для данной системы газ – жидкость при t = const и П = const. Из закона Генри и его подробного рассмотрения следует, что растворимость газа в жидкости увеличивается с повышением давления П и понижением температуры. Для понижения температуры - охлаждают исходную газовую смесь и поглотитель, - отводят теплоту, выделяющуюся в процессе абсорбции, с помощью встроенных (внутренних) или наружных теплообменников. В некоторых случаях отвод теплоты абсорбции осуществляют без охлаждения (используют эту теплоту для концентрирования раствора в самом абсорбере). По данным о растворимости поглощаемых компонентов осуществляется выбор поглотителей (абсорбентов), так как с практической точки зрения лучшим из ряда возможных будет тот поглотитель, расход которого для проведения процесса будет меньшим.
Для практических расчетов пользуются полученными из опыта значениями равновесного парциального давления газа р* и вычисляют равновесное содержание абсорбируемого компонента в газовой смеси У* по уравнению Рауля-Дальтона у* = (р/П)х, где р – давление паров чистого компонента, определяемое по закону Рауля, как р =р*/х; П – общее давление газовой смеси.
Формула для расчёта (Пл. 16-12, с.591):
где Мк и Мн — молекулярные массы абсорбируемого компонента и инертного (неабсорбируемого) газа;
Р—общее давление газовой смеси. 5 По найденным значениям У* строят линию равновесия (стр. 567, Пл). При небольших значениях р*, по сравнению с Р, можно приближенно написать, учитывая уравнение (17-l):
где
В этом случае линия равновесия представляет собой прямую, тангенс угла наклона которой равен k.
ПиА НГ (2) Занятие № 42
|
||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 166; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.109.141 (0.009 с.) |
 )
)