
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 2 основные законы химииСтр 1 из 7Следующая ⇒
СОДЕРЖАНИЕ ПОЯСНИТЕЛЬНАЯ ЗАПИСКА ………………………………………………..4 ТЕМА 1 ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ……………………………………5 ТЕМА 2 ОСНОВНЫЕ ЗАКОНЫ ХИМИИ……………………………………..9 ТЕМА 3 ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА…………………………………..18 ТЕМА 4 ХИМИЧЕСКАЯ СВЯЗЬ………………………………………………21 ТЕМА 5 ОБМЕНА……………………………………………………………..24
ТЕМА 6 РАСТВОРЫ. МАССОВАЯ ДОЛЯ РАСТВОРЕННОГО ВЕЩЕСТВА……………………………………………………………………...27 ТЕМА 7 СТЕПЕНЬ ОКИСЛЕНИЯ. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ………………………………………...30 ТЕМА 8 КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ………………….34 ЛИТЕРАТУРА……………………………………………………………….......40 ПРИЛОЖЕНИЯ………………………………………………………………….41 Растворимость оснований, кислот и солей в воде……………………………..42 Периодическая система химических элементов Д.И. Менделеева…………..43 ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Химия является одной из фундаментальных естественно – научных дисциплин. В настоящее время большое значение придается практической направленности обучения. Умение применять теоретические знания при решении задач и выполнении упражнений является одним из определяющих факторов при оценке уровня знаний обучающихся. Решение задач и выполнение упражнений позволяет: · расширять кругозор обучающихся; · развивать умение логически мыслить; · воспитывать самостоятельность, внимательность, умение анализировать, делать правильные выводы; · устанавливать связь химии с другими науками: физикой, математикой; · способствует подготовиться к успешной аттестации по предмету. Умение решать задачи и выполнять упражнения по химии является основным критерием творческого усвоения дисциплин. Это эффективный способ проверки знаний и важное средство их закрепления. Методические указания и контрольные задания состоят из 8 тем. В каждой теме изложены основные понятия и теоретические аспекты, приведены примеры решения задач и выполнения упражнений, а также контрольные задания. Для организации самостоятельной работы обучающихся в каждой теме предложено 30 вариантов контрольных заданий. К контрольным заданиям по темам: «Основные понятия химии», «Основные законы химии», «Растворы. Массовая доля растворенного вещества» указаны ответы, что позволяет оценить вероятность и достоверность ответа, полученного в результате решения задачи.
Порядок выполнения заданий и варианты определяет учитель в зависимости от уровня полученных знаний 8-11 класс. Задания могут выполняться либо на учебном занятии, либо при подготовке домашнего задания. Каждое задание должно быть аккуратно оформлено: указан номер контрольного задания, вариант, переписано условие задания, записаны необходимые формулы и дан четкий ответ. При решении задачи нужно приводить все математические преобразования, избирая простейший путь решения или опираться на предложенный алгоритм. При выполнении заданий следует пользоваться Периодической системой элементов Д.И. Менделеева, таблицей растворимости оснований, кислот, солей.
ТЕМА 1 ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ Молекула - наименьшая частица вещества, обладающая его химическими свойствами. Атом – электронейтральная, химически неделимая частица вещества. Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы. Химический элемент – это определенный вид атомов, с одинаковым положительным зарядом ядра. Относительная атомная масса (А r) – величина, равная отношению средней массы атома естественного изотопического состава элемента к 1/12 массы атома углерода 12С. Значения относительных атомных масс приведены в периодической системе Д.И. Менделеева. Относительная молекулярная масса (М r) – величина, равная отношению средней массы молекулы естественного изотопического состава вещества к 1/12 массы атома углерода 12С. Значения относительных атомных масс приведены в периодической системе Д.И. Менделеева. Относительная молекулярная масса числено, равна сумме относительных масс всех атомов, входящих в молекулу. Например, Мr(Н2О) = Аr(H) · 2 + Аr(O) = 1· 2 +16 = 18 Моль (n) – количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов, электронов и др), сколько атомов содержится в 0,012 кг изотопа углерода 12С.
Молярная масса (М) – величина, равная отношению массы вещества (m) к количеству вещества (n). Молярный объем (Vm) – это отношение объема газообразного вещества к количеству вещества. При нормальных условиях 1 моль любого газа равен Vm = 22,4 л/моль
Примеры решения задач Задача 1. Вычислить массу метана количеством вещества 0,1 моль.
Задача 2. Вычислить объем углекислого газа при н.у., взятого количеством вещества 3 моль.
Задача 3. Вычислить массу углекислого газа, занимающего при н.у. объем 28 л.
Контрольное задание № 1 Тема: «Основные понятия химии» 1. Найдите количество вещества сульфата алюминия Al2(SO4)3 массой 34,2. 2. Найдите количество вещества карбоната кальция CaCO3 массой 25 г. 3. Определите массу 0,25 моль серной кислоты. 4. Рассчитайте количество вещества в 256 г сернистого газа SO2. 5. Найти массу 1,5 моль гидроксида натрия NaOH. 6. Какое количество вещества составляет 67,2 л кислорода при н.у.? 7. Какое количество вещества составляет вода массой 450 г? 8. Определите массу иодида натрия NaI количеством вещества 0,6 моль. 9. Найти количество вещества хлорида натрия массой 5,85 г. 10. Рассчитать количество вещества оксида кальция СаО массой 28 г. 11. Какова масса 0,25 моль хлорида меди (II) СаCl2. 12. Какой объем при н.у. займет аммиак NH3 массой 51 г? 13. Определите объем, который займет при нормальных условиях газовая смесь, содержащая водород, массой 1,4 г и азот, массой 5,6 г. 14. Какой объём при нормальных условиях занимают 7г азота N 2? 15. Найдите массу 5,6 л. азота при н.у.. 16. Какой объём занимает оксид серы IV SO2 массой 80г? 17. Рассчитайте, какой объем занимают 5 моль аммиака NH3 при н. у. 18. Рассчитайте, какой объем при нормальных условиях займет оксид углерода (IV) СО2 массой 5,6 г. 19. Определите массу 5 л аммиака NH3, при н. у. Какое количество вещества аммиака заключено в этом объеме? 20. Вычислите объем, который займет при нормальных условиях бромоводород HBr массой 48,6 г. 21. Какой объем при н.у. занимают 64 г оксида серы (IV) SO2. 22. Какой объем занимают (при н.у.) 280 кг азота? 23. Какую массу имеют 112л (при н.у.) углекислого газа СО2? 24. Какой объем при н.у. занимают 96 г озона О3. 25. Какую массу имеют 44,8 л при н.у. угарного газа (СО). 26. Найти количество вещества, которое составляет 49 г гидроксида меди (II) Cu(OH)2.
27. Какова масса 10 л хлора, измеренного при н.у.? 28. Чему равен объем 6 г азота при н.у.? 29. Определить молекулярную массу газа, если 5 г его при нормальных условиях занимают объем 4 л. 30. Чему равна масса N2 объемом 1 м3 . Ответы: 1. 0,1 моль; 2. 0,25 моль; 3. 24,5 г; 4. 4 моль; 5. 60 г; 6. 3 моль; 7. 25 моль; 8. 90 г; 9. 0,1 моль; 10. 0,5 моль; 11. 33,75 г; 12. 29,2 л; 13. 20,16 л; 14. 5,6 л; 15. 7 г; 16. 28 л; 17. 112 л; 18. 1,96 л; 19. 3,79 г.; 0,22 моль; 20. 13,44 л; 21. 22,4 л; 22. 224 м3; 23. 220 г; 24. 44,8 л; 25. 56 г; 26. 0,5 моль; 27. 32,0 г. 28. 4,7 л; 29. 28; 30. 1,25 кг.
Примеры решения задач по химическим формулам Задача 1. Вычислить массовую долю каждого атома в сульфате меди (II) CuSO4
Задача 2. Соединение содержит 36,5% натрия, 25,4% серы и 38,1% кислорода. Определить формулу вещества.
Примеры решения задач по уравнению реакции Задача 1. Вычислить массу кислорода, выделившейся в результате разложения порции воды массой 9 г.
Задача 2. Вычислить объем кислорода (н. у.), выделившейся в результате разложения порции воды массой 9 г.
Контрольные задания № 2 Варианты заданий
1. Найти массовые доли химических элементов в сульфате алюминия (Al2(SO4)3). 2. Вычислите массовые доли элементов в молекуле серной кислоты H2SO4. 3. Вычислите массовые доли элементов в молекуле оксида железа (III) Fe2O3. 4. Вычислите массовые доли элементов в гидроксиде натрия NaOH. 5. Определить массовые доли элементов в оксиде железа(III) Fe2O3. 6. Определите простейшую формулу соединения калия с марганцем и кислородом, если массовые доли элементов в этом веществе составляют соответственно 24,7, 34,8 и 40,5%.. 7. Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. 8. Вычислите массовую долю кислорода в карбонате кальция СаСО3. 9. Элементный состав вещества следующий: массовая доля элемента железа 0,7241 (или 72,41 %), массовая доля кислорода 0,2759 (или 27,59 %). Выведите химическую формулу. 10. Анализ газа показал, что соединение содержит 5,9% H2 и 94,1% S; масса 1л этого газа равна 1,52г (н.у.) Какой это газ? 11. Вещество содержит 11,3% углерода, 43,4 % натрия и 45,3% кислорода. Определите формулу. 12. Определите формулу вещества, имеющего состав: 87,5% азота, 12,5% водорода. Относительная молекулярная масса вещества – 32. 13. Какова формула соединения, в котором массовая доля калия составляет 56,5%, углерода – 8,7%, кислорода – 34,8%.
14. Найти простейшую формулу оксида хрома, содержащего 68,4 % хрома. 15. Какова формула кристаллогидрата, содержащего Mg – 9,8 %, S – 13 %, О – 26 %, Н2О – 51,2%. 16. Определить формулу вещества, в состав которого входит 40% серы и 60 % кислорода. Относительная молекулярная масса вещества 80. 17. Какова простейшая формула вещества, в котором массовые доли серы, железа и кислорода равны соответственно 24, 28 и 48 % 18. Найти простейшую формулу вещества, имеющего следующий состав: сера 50%, кислород 50%. 19. Найти простейшую формулу вещества, имеющего следующий состав: алюминий 75%, углерод 25%. 20. Определить формулу вещества, имеющего следующий состав: калий 70,9%; кислород 29,1% и относительную молекулярную массу 110. 21. Выведите простейшую формулу вещества, содержащего азот – 63,64% и кислород – 36,36% 22. Найти формулу гипосульфита натрия, если состав этого соединения следующий: Na – 29,1%, S – 40,5%, О – 27%. 23. Выведите формулу минерала, содержащего ZnO – 73% и SiO2 – 30,4%. 24. Определите химическую формулу оксида марганца, если он содержит 63,2% Mn и О. 36,8%. 25. Рассчитайте массовые доли в процентах каждого элемента в фосфорной кислоте. 26. Известно, что вещество состоит из 0,4 (40%) массовых долей кальция Са, 0,12 (12%) массовых долей углерода С и 0,48 (48%) массовых долей кислорода О. Вывести химическую формулу этого вещества. 27. Два оксида азота имеют один и тот же состав:N- 30,43%,кислород – 69,57%. Относительная плотность их по водороду а)23, б) 46. Выведите формулы этих соединений. 28. Вычислите процентное содержание воды в кристаллогидратах: а) Na2SO4 ∙ 10H2O б) MgSO4 ∙ 7H2O. 29. Выведите формулу кристаллогидрата следующего состава: Na – 14,28%, S– 9,95% О – 69,50, Н – 6,27%. 30. Установите истинную формулу вещества по следующим экспериментальным данным: С – 27,27%, О – 72,785, Dвозд = 1,52. 31. Сколько граммов соляной кислоты HCl может вступить во взаимодействие с магнием массой 4,8 г 32. Какое количество вещества ортофосфорной кислоты можно получить при нагревании 28,7г оксида фосфора (V) с водой? 33. Какую массу фосфора надо сжечь для получения оксида фосфора (V) массой 7,1 г? 34. При взаимодействии гидроксида натрия и углекислым газом образовался 21 г гидрокарбоната натрия NaHCO3. Сколько граммов NaOH для этого потребовалось. 35. Сколько граммов оксида алюминия образуется при восстановлении алюминием оксида железа (III) Fe2O3 массой 800 г 36. Сколько граммов карбоната кальция СаСО3 потребуется для получения 112 л СО2 при действии HCl на СаСО3 37. Какой объем водорода выделится при взаимодействии 130 г цинка с соляной кислотой по уравнению Zn+2HCl = ZnCl2+H2? 38. При разложении какой массы воды получается 4 г кислорода? 39. Сколько граммов соляной кислоты HCl может вступить во взаимодействие с 4,8 г магния? Ответы: 1. Al = 15,8%, S = 28,1%, O = 56,1%; 2 Н = 2,04%, S = 32,65 %, О = 65,31 %; 3. Fe = 70%, О = 30%; 4. Na = 57,5 %, O = 40 %, Н = 2,5 %; 5. Fe = 70%; О = 30%; 6. KMnO4; 7. NaNO3 8. 48%; 9. Fe3O4 10. H2 S; 11. Na2CO3. 12. NH3; 13. K2CO3; 14. Cr2O3; 15. MgSО4 ∙ 7Н2О; 16. SO3; 17. Fe2(SО4)3; 18. SO2; 19. Al4C3; 20. К2О2; 21. NO; 22. Na2S2О3; 23. 2ZnO ∙ SiO2; 24. MnО2; 25. Н – 3,1%, Р- 65,3 %, О – 31,6%; 26. СаСО3; 27. NO2 , N2O4; 28. 63% 51,22%; 29. Na2SO4 ∙ 10H2O 30. CO2; 31. 146 г; 32. 0,4 моль; 33. 3,1 г; 34. 10 г; 35. 510 г; 36. 1,15 г; 37. 11,2 г; 38. 4 г.; 39. 9,4 г; 40. 4,5г; 4 1. 14,2 г; 42. 40 г. 43. 6,3 г; 44. 39,5 г.; 45. 500 г; 46. 44,8 л; 47. 169,7 г; 48. 5,6 л; 49. 3,4 л; 50. 56 л; 51. 13.6 г; 52. 11,2 л; 53. 2,8; 54. 4,96 г; 55. 2,24 л; 56. 4,45 г; 57. 54,1 г; 58. 5,6 л; 59. 17,6 г; 60. 44,8 л;
Варианты заданий
ТЕМА № 4: ХИМИЧЕСКАЯ СВЯЗЬ Химическая связь – взаимодействие атомов, приводящее к образованию устойчивой многоатомной системы. Различают три основных типа химической связи: ковалентная, ионная, металлическая. Ковалентная связь – это связь, образованная за счет обобществления общих электронных пар. Различают два вида ковалентной связи: полярная и неполярная. Таблица 1-виды ковалентной связи Виды ковалентной связи
Донорно-акцепторный механизм образования ковалентной связи. В этом случае химическая связь возникает за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора). Пример: образование иона аммония NH4+. В молекуле аммиака NH3 азот имеет одну неподеленную пару электронов (двухэлектронное облако), у иона водорода одна свободная орбиталь.
  Н Н + Н Н +
: N: + Н+ →: N: Н · · · · Н Н
При образовании иона аммония двухэлектронное облако азота становится общим для азота и водорода, образуется четвертая ковалентная связь. Ионная связь – химическая связь, возникающая между ионами за счет сил кулоновского притяжения между атомами металла и неметалла. Ионы – положительно или отрицательно заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов. Пример: образование химической связи в молекуле NaCl. Na ˙ - 1ē →Na+ .. : Cl · + 1ē →Сl¯ ˙˙ Na+ + Сl¯ → NaCl Металлическая связь – это связь между ионами металлов, расположенными в узлах кристаллической решетки, осуществляемая за счет обобществления внешних электронов. Электроны играют роль цемента, удерживая вместе положительные ионы, в противном случае решётка распалась бы под действием сил отталкивания между ионами. Металлическая связь характерна для металлов в твердом и жидком состоянии.
Контрольное задание № 4 Тема «Химическая связь» 1.Определить тип связи в молекулах. 2. В первой молекуле показать механизм образования связи. Варианты заданий
Варианты заданий 1. Вычислить массовую долю раствора, полученного при растворении 30г вещества в 600 г воды. 2. Смешали 0,4 г соли и 200 мл воды. Какова массовая доля соли в полученном растворе? 3. Какую массу соли и объем воды необходимо взять для приготовления 70 г 2 % раствора? 4. Смешали 20 г сахара и 250 мл воды. Какова массовая доля сахара в полученном растворе? 5. Смешали 2 г соли и 140 мл воды. Какова массовая доля соли в полученном растворе? 6. Какую массу соли и объем воды необходимо взять для приготовления 60 г 1 % раствора? 7. Смешали 0,5 г соли и 300 мл воды. Какова массовая доля соли в полученном растворе? 8. Смешали гидроксид натрия NaOH в количестве 1 моль с 1 л воды. Какова массовая доля гидроксида натрия в полученном растворе? 9. Смешали нитрат натрия NaNO3 в количестве 0,1 моль с 0,5 л воды. Какова массовая доля нитрата натрия в полученном растворе? 10. При выпаривании раствора массой 500 г образовалось 25 г кристаллической соли хлорида натрия. Вычислите массовую долю соли в исходном растворе. 11. Какую массу соли и объем воды необходимо взять для приготовления 70 г 2 % раствора? 12. После выпаривания 200 г раствора соли получили 3 г кристаллической соли. Какова массовая доля растворенного вещества в растворе? 13. Для приготовления раствора сульфата меди (II) использовали 50г соли и 450г воды. Определите массовую долю сульфата меди(II) в полученном растворе. 14. Сколько хлорида магния содержится в 800 мл раствора с массовой долей MgCl2 10% (пл. 1,06 г/см3)? 15. Какую массу поваренной соли и воды необходимо взять для приготовления 300г раствора с массовой долей 15%? 16. Вычислить массовую долю раствора, полученного при растворении 30г вещества в 600 г воды. 17. Вычислите массовую долю (в %) хлороводорода в растворе соляной кислоты, содержащем 14,6 кислоты и 385,4 г воды. 18. Сколько граммов гидроксида калия содержится в растворе объемом 200 мл с массовой долей КОН 10%, плотность которого равна 1,09 г/см3. 19. Вычислить массовую долю раствора содержащего 2 моля соды Na2CO3 в 0,5 л воды? 20. Какую массу соли и объем воды необходимо взять для приготовления 50 г 0,5 % раствора? 21. К 200 г 40 %-ного раствора серной кислоты прилили 80 мл воды. Каково процентное содержание серной кислоты во вновь полученном растворе? 22. Какая масса азотной кислоты содержится в 178 г 30%-ого раствора? 23. К 150 г 20 %-ного раствора соляной кислоты прилили 200 мл воды. Каково процентное содержание соляной кислоты во вновь полученном растворе? 24. Какой объем аммиака потребуется для приготовления 20% раствора (p=0,926г/мл), объемом 2 литра? 25. Определите массовую долю растворенного вещества в растворе, полученном при растворение 10 г соли в 70 г воды. 26. К 80 г 30 %-ного раствора щелочи долили 420 мл воды. Каково процентное содержание щелочи во вновь полученном растворе? 27. Какая масса гидроксида натрия содержится в 200 г 5%-ого раствора? 28. Вычислите массу сульфата меди (II) необходимо для приготовления 60 г раствора медного купороса с массовой долей соли 5%. 29. Какая масса карбоната натрия потребуется для приготовления 0,5 л 13%-ного раствора плотностью 1,13 г/мл? 30. Какова массовая доля (%) хлорида бария в растворе (r = 1,08 г/мл), 200 мл которого содержат 0,4 моль соли? Ответы: 1. 5%; 2. 0,2%.; 3. 1,4 г; 68,6 мл; 4. 7,4%.; 5. 1,4%.; 6. 0,6 г, 59,4 мл; 7. 0, 166%.; 8. 3,8%; 9. 1,67%; 10. 5%; 11. 1,4 г; 68,6 мл; 12. 1,5%; 13. 10%; 14. 84,8 г; 15. 45 г, 255 г; 16. 4,76%; 17. 3,65 %; 18. 21,8 г; 19. 29,7 %. 20. 0,25 г; 49,75 мл; 21. 28,6 %; 22. 53,4 г. 23. 8,6 %.; 24. 488,32 л; 25. 12,5 %; 26. 4,8 %; 27. 10 г; 28. 3 г; 29. 73,45 г; 30. 38,5 г.
Варианты заданий
Свойства оксидов 1. Оксид щелочного металла + вода = щелочь; К2О + Н2О → 2КОН щелочные металлы: Li, Na, К, Rb, Сs, Fr, Са, Ва. 2. Основный оксид + кислота; Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O 3. Основный оксид + кислотный = соль; CaO + CO2 → CaCO3 4. Кислотный оксид + вода = кислота; SO3 + H2O→ H2SO4 5. Кислотный оксид + щелочь = соль + вода; N2O5 + Ca(OH)2 → CaCO3 + H2O Основания – сложные вещества, состоящие их ионов металла и гидроксогруппы (OH-). Основания делятся на растворимые в воде или щелочи: NaOH, КОН, Сa(OH)2, Ва(ОН)2 и нерастворимые в воде Сu(OH)2, Fl(OH)2, Al(OH)3, Zn(OH)2 и др. Получение оснований 1. Оксид щелочного металла + вода = щелочь; СаО + Н2О→ Са(ОН)2 2. Щелочной металл + вода = щелочь; 2Na+H2O→ 2NaOH + H2 3. Соль + щелочь = нерастворимое основание + соль СuSO4 + 2NaOH → Cu(OH)2 + Na2SO4 Амфотерные основания – соединения, которые в зависимости от условий проявляют кислотные или основные свойства, т.е. проявляют двойственность. Zn(OH)2, Be(OH)2, Al(OH)3. 1. С кислотами, проявляет свойства оснований. Zn(OH)2 + H2SO4 → ZnSO4 + H2O основание кислота 2. С основаниями, проявляет свойства кислот. в расплаве: Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O кислота основание
в растворе: Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] + 2H2O
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 175; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.187.233 (0.193 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
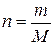 (1), отсюда m = n ∙ M (2)
(1), отсюда m = n ∙ M (2)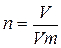 (1), отсюда V = n ∙ Vm (2)
(1), отсюда V = n ∙ Vm (2)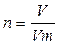 , Vm = 22,4 л/моль при н.у.
, Vm = 22,4 л/моль при н.у.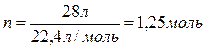
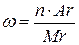 · 100%
· 100%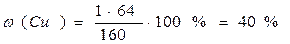
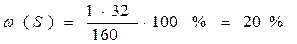
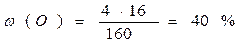
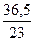 :
: 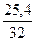 :
: 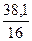
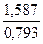 :
: 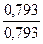 :
: 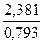
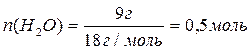
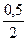 =
= 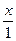 , откуда х = 0,25 моль,
, откуда х = 0,25 моль,



