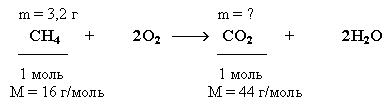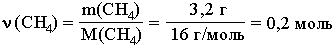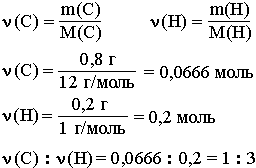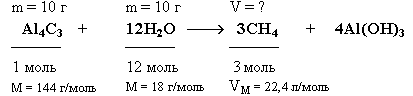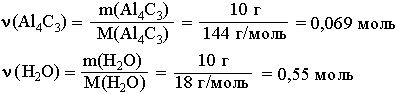Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчеты по уравнениям реакцийСодержание книги Поиск на нашем сайте
Расчеты, связанные с уравнениями реакций, называются стехиометрическими. Они основаны на законе сохранения массы веществ и позволяют решать следующие задачи:
Стехиометрические расчеты используются также для решения задач, обратных вышеперечисленным. В расчетах по уравнениям реакций важно уметь правильно расставить стехиометрические коэффициенты. Для уравнивания реакций можно использовать прикладную программу ChemEquation Expert.Вид рабочего окна этой программы приведен на рис. 1. Рис. 1. Рабочее окно программы ChemEquation Expert 3.6.1. Расчет массы (объема, количества) продуктов реакции по массе (объему, количеству вещества) исходных веществ и обратные вычисления Задача. Какую массу углекислого газа можно получить, если сжечь Краткие условия в данном случае целесообразно записать, учитывая уравнение реакции сгорания метана, следующим образом:
Решение
2. Количество углекислого газа согласно уравнению реакции равно количеству метана:
ν(CO2) = ν (CH4) = 0,2 моль
3. Определяем массу CO2:
m(CO2) = ν (CO2) * M(CO2) = 0,2 моль * 44 г/моль = 8,8 г Ответ: m(CO2) = 8,8 г Вывод формул соединений
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу. Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Целые числа (1 и 3) получены делением числа 0,2 на число 0,0666. Число 0,0666 примем за 1. Число 0,2 в 3 раза больше, чем число 0,0666. Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1:3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15. Тогда M(CxHy) = 15 M(H2) = 15*2 г/моль = 30 г/моль. Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6. Определение формулы вещества зависит от точности математических вычислений. При нахождении значения ν элемента следует учитывать хотя бы два – а лучше три! - знака после запятой и аккуратно производить округление чисел. Например, 0,8878 ~ 0,89 но не 1. Соотношение атомов в молекуле не всегда определяется простым делением полученных чисел на меньшее число. Рассмотрим этот случай на следующем примере. Задача 1. Установите формулу вещества, которое состоит из углерода (ω=25%) и алюминия (ω=75%).
Разделим 2,08 на 2. Полученное число 1,04 не укладывается целое число раз в числе 2,78 (2,78:1,04 = 2,67:1). Теперь разделим 2,08 на 3. При этом получается число 0,69, которое укладывается ровно 4 раза в числе 2,78 и 3 раза в числе 2,08. Следовательно, индексы x и y в формуле вещества AlxCy равны 4 и 3, соответственно. Ответ: Al4C3 (карбид алюминия).
Более сложным вариантом задач на вывод формул соединений является случай, когда состав вещества задается через продукты сгорания этих соединений. Задача 2. При сжигании углеводорода массой 8,316 г образовалось 26,4 г CO2. Плотность вещества при нормальных условиях равна 1,875 г/мл. Найдите его молекулярную формулу.
3.6.2. Расчет массы (объема, количества) продуктов реакции при условии, что одно из реагирующих веществ взято в избытке Задача. Какой объем метана (н.у.) выделится при взаимодействии 10 г карбида алюминия (Al4C3) с 10 г воды?
Краткие условия:
Решение
1. Находим количества вступивших в реакцию веществ: 2.
Так как на 1 моль Al4C3 требуется в 12 раз большее количество вещества воды, то на 0,069 моль Al4C3 необходимо 0,828 моль воды. Следовательно, 0,55 моль воды недостаточно для реакции с 0,069 моль Al4C3, который взят в избытке и прореагирует не полностью. 2. Определим ν (CH4) по веществу, взятому в недостатке:
3. Рассчитаем объем метана, образовавшегося в реакции:
V(CH4) = ν (CH4)* Vm = 0,137 моль * 22,4 л/моль = 3,07 л Ответ: V(CH4) = 3,07 л
|
||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 147; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.28.173 (0.008 с.) |

 определить массовые (объемные) доли примесей в исходном веществе,
определить массовые (объемные) доли примесей в исходном веществе,