
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Катионы 1 аналитической группы
Практическое занятие № 2 Тема: Качественные реакции катионов 1 и 2 аналитических групп. Методическая установка: Сегодня на занятии мы должны изучить химические свойства и качественные реакции катионов 1 и 2 аналитических групп, овладеть методикой проведения качественных и фармакопейных реакций катионов 1 и 2 аналитических групп. Катионы 1 и 2 групп часто входят в состав лекарственных веществ, являются допустимыми или недопустимыми примесями в лекарственных препаратах. Фармацевты в своей работе ежедневно проводят фармакопейные реакции на перечисленные катионы. Поэтому необходимо овладеть методикой проведения качественных реакций на катион 1 и 2 аналитических групп. Таким образом, вы должны иметь представление о химических свойствах и качественных реакциях катионов 1 и 2 аналитических групп, знать принцип классификации катионов на группы, действие группового реактива, уметь проводить фармакопейные реакции на калий, натрий, аммоний, серебро, ртуть, свинец
Натрий и калий. Ионы Nа+ и К+ распределены по всему организму, причем первые входят преимущественно в состав межклеточных жидкостей, а вторые находятся главным образом внутри клеток. Внутриклеточная концентрация ионов натрия составляет менее 10 % его содержания во внеклеточной жидкости, тогда как концентрация ионов калия внутри почти в 30 раз выше, чем вне их. Если оценивать абсолютные величины, то примерно 95 % ионов натрия, участвующих в обмене веществ, находятся вне клеток и примерно такая же доля ионов калия - внутри клеток. С ионами Nа+ связано осмотическое давление жидкостей, удержание воды тканями (15 г NаС1 задерживает в организме человека до двух литров жидкости), поддержание кислотно-щелочного равновесия в организме (NаНС03 - щелочной резерв крови - компонент гидрокарбонатной буферной системы), перенос аминокислот и cахаров через клеточную мембрану. Ионы Nа+ и К+ активируют аденозинтрифосфатазу клеточных мембран, которая «включает» ионы Nа+ из клетки и обеспечивает сопряженное накопление ионов К+ в ней. Различные концентрации двух данных ионов по разные стороны от мембраны обусловливают возникновение трансмембранной разности потенциалов (до 100 мВ), что обеспечивает существование легкодоступного источника энергии для многих связанных с функционированием мембран процессов.
Ионы Nа+ и К+ оказывают существенное влияние на деятельность центральной нервной системы (ЦНС). Так, избыток ионов Nа+ в клетках коры головного мозга вызывает депрессию, т.е. угнетение деятельности ЦНС. Наоборот, избыток ионов К+ в клетках коры головного мозга вызывает маниакальное состояние, т.е. возбуждение деятельности ЦНС. В практике применяются: 1. Хлорид натрия NаС1. В зависимости от его концентрации различают изотонический (физиологический) и гипертонический растворы. Изотоническим является 0,9 %-ный раствор NаС1, так как его осмотическое давление соответствует осмотическому давлению плазмы крови (780,2 кПа). Изотонический раствор применяют в качестве плазмо-замещающего раствора при обезвоживании организма, для растворения лекарственных веществ и т.д. Гипертонические растворы (с массовой долей NаС1 3, 5 и 10 %) применяют наружно в виде компрессов и примочек для лечения гнойных ран. 2. Гидрокарбонат натрия NаНС03 (питьевая сода). Введение гидрокарбоната натрия в желудок приводит к быстрой нейтрализации соляной кислоты желудочного сока и поэтому рассматривается как антацидное средство. Применяют в порошках, таблетках и растворах при повышенной кислотности желудочного сока, язвенной болезни желудка и двенадцатиперстной кишки: NаНС03 + НС1 = NаС1 + Н20 + С02. 3. Декагидрат сульфата натрия Nа2S04 • 10Н2О (глауберова соль). Назначают внутрь в качестве слабительного средства. 4. Декагидрат тетрабората натрия Nа2В407 • 10Н2О (бура). Применяют наружно как антисептическое средство для спринцеваний, полосканий, смазываний, В водных растворах бура легко подвергается гидролизу: Nа2В407 + 7Н20 = 4Н3В03 + 2 NаОН. Образующаяся при гидролизе борная кислота обладает антисептическим действием. 5. Йодид натрия NаI. Используют как препарат йода при эндемическом зобе. 6. Хлорид калия КС l. Применяют при состояниях, сопровождающихся нарушением электролитного обмена в организме (неукротимая рвота, профузные поносы), а также для купирования сердечных аритмий. 7. Йодид калия К I. Применяют как препарат йода при заболеваниях щитовидной железы.
8. Перманганат калия КМ n04. Используют как антисептическое средство для промывания ран, полоскания рта и горла, для спринцеваний и промываний. 9. Водный раствор аммиака, гидроксид аммония (нашатырный спирт) NH4ОН. Используют для возбуждения дыхания и выведения больных из обморочного состояния, для чего небольшой кусок ваты или марли, смоченной в нашатырном спирте, осторожно подносят к носовым отверстиям. 10. Хлорид аммония (нашатырь) NH4С1. Оказывает отхаркивающее действие, усиливает мочеотделение. Свинец. Биологическая роль свинца не установлена. Его соединения токсичны. У рабочих различных производств, связанных с получением и применением свинца, могут встречаться явления острого и хронического отравления (сатурнизм). При сатурнизме наблюдается ряд симптомов поражения ЦНС (головная боль, бессонница, судороги, галлюцинации, атрофия зрительного нерва), а также нарушения функции почек (альбуминурия) и желудочно-кишечного тракта («свинцовые колики»). В медицине соединения свинца применяются только наружно как антисептические и вяжущие средства. Оксид свинца РЬО входит в состав свинцового пластыря, используемого при воспалительных заболеваниях кожи, фурункулезе.Добавки свинца используют при изготовлении одежды для медперсонала рентгеновских кабинетов (фартуки, рукавицы, шлемы), так как свинец поглощает рентгеновские лучи. Серебро. Физиологическая роль серебра в живом организме изучена недостаточно. Серебро относится к ультра микроэлементам. Это означает, что оно находится в организме в концентрации менее 10-12 %. В медицине применяются: 1. Нитрат серебра А gNO3 (ляпис) - вяжущее и прижигающее средство, используется наружно. Применяется в стоматологии для серебрения корневых каналов и кариозных полостей зубов перед их пломбированием. Сначала из нитрата серебра получают аммиачный раствор оксида серебра, затем добавляют водный раствор формальдегида с его массовой долей 10 %. Образующаяся серебряная пленка посылает в окружающее пространство ионы серебра, которые обладают бактерицидным действием. 2. Нитрат и хлорид серебра применяются для пропитки перевязочного материала - бумаги, ваты, марли. Ртуть. Ртутное заражение почвы, природных вод, растений и животных в настоящее время характерно для многих регионов планеты. Оно связано с поступлением в биосферу большого количества ртути в виде продуктов промышленного производства, выхлопов транспорта, ядохимикатов. Ртуть накапливается главным образом в печени и почках. При хроническом отравлении ртутью и ее соединениями («меркуризм») появляются металлический привкус во рту, сильное слюнотечение, слуховые и обонятельные галлюцинации, головные боли, наблюдается ослабление памяти.
Применяются в медицине: 1. Желтая ртутная мазь - оксид ртути (II). Используется для лечения кожных заболеваний. 2. Хлорид ртути (II) Н gС12 (сулема). Обладает высокой токсичностью, при работе с ней необходимо соблюдать большую осторожность; растворы в разведении 1:1000 применяются для дезинфекции белья, предметов ухода за больными, помещений, медицинского инструментария. В медицине используют не только соединения, но и саму ртуть и ее пары (ртутные термометры, ртутные манометры в аппаратах для измерения кровяного давления).Ультрафиолетовые лучи, полученные от ртутно-кварцевых ламп, глубоко прогревают ткани, губительно действуют на многие микроорганизмы.
II. Контроль исходного уровня знаний 1. Фронтальный опрос по качественным реакциям (Приложение 1). 2. Индивидуальный письменный опрос. Задания на карточках. Написать качественные реакции на предложенный катион III. Самостоятельная работа Вводный инструктаж. Выполнить качественные и групповые реакции на катионы 1 и 2 аналитических групп. (Приложение 2). Результаты работы оформить в тетради в виде таблицы. Перед проведением химических реакций необходимо помнить о технике безопасности в химической лаборатории. Работа проводится индивидуально.
IV. Закрепление пройденного материала. Выполнение анализа смеси катионов 1 и 2 аналитических групп (приложение 3). V. Подведение итогов занятия. VI .Задание на дом. Тема: «Качественные реакции катионов 3 и 4 аналитических групп». Вопросы для самоподготовки: 1. Действие группового реактива катионы 3 и 4 аналитических групп. 2. Качественные реакции катионов 3 и 4 аналитических групп. Приложение 1 Фронтальный опрос. 1. Назвать методы качественного анализа по количеству анализируемого вещества и реагента. 2.. Назвать методы качественного анализа по агрегатному состоянию реагирующих веществ. 3. Перечислить классификацию реактивов по их чистоте. 4. Дать характеристику кислотно-основной классификации катионов. 5. Перечислить катионы 1 аналитической группы. Назвать групповой реактив. 6.Перечислить катионы 1 аналитической группы. Назвать групповой реактив. 7. Почему открытие катиона калия гидротартратом натрия должно проводиться в нейтральной среде? Написать уравнение реакций. 8.Почему осаждение катиона Na в виде дигидроантимоната натрия должно проводиться в нейтральной, а не в кислой или щелочной среде? 9. Почему перед открытием катиона К необходимо удалить катион NH4 +? 10. При действии группового реагента на катионы второй группы получаются осадки – хлориды соответствующих катионов: AgCl, Hg2Cl2, PbCl2. Какова растворимость хлоридов в воде и как это используется в анализе?
Приложение 2.
Практическое занятие № 2 Тема: Качественные реакции катионов 1 и 2 аналитических групп. Методическая установка: Сегодня на занятии мы должны изучить химические свойства и качественные реакции катионов 1 и 2 аналитических групп, овладеть методикой проведения качественных и фармакопейных реакций катионов 1 и 2 аналитических групп. Катионы 1 и 2 групп часто входят в состав лекарственных веществ, являются допустимыми или недопустимыми примесями в лекарственных препаратах. Фармацевты в своей работе ежедневно проводят фармакопейные реакции на перечисленные катионы. Поэтому необходимо овладеть методикой проведения качественных реакций на катион 1 и 2 аналитических групп. Таким образом, вы должны иметь представление о химических свойствах и качественных реакциях катионов 1 и 2 аналитических групп, знать принцип классификации катионов на группы, действие группового реактива, уметь проводить фармакопейные реакции на калий, натрий, аммоний, серебро, ртуть, свинец
Натрий и калий. Ионы Nа+ и К+ распределены по всему организму, причем первые входят преимущественно в состав межклеточных жидкостей, а вторые находятся главным образом внутри клеток. Внутриклеточная концентрация ионов натрия составляет менее 10 % его содержания во внеклеточной жидкости, тогда как концентрация ионов калия внутри почти в 30 раз выше, чем вне их. Если оценивать абсолютные величины, то примерно 95 % ионов натрия, участвующих в обмене веществ, находятся вне клеток и примерно такая же доля ионов калия - внутри клеток. С ионами Nа+ связано осмотическое давление жидкостей, удержание воды тканями (15 г NаС1 задерживает в организме человека до двух литров жидкости), поддержание кислотно-щелочного равновесия в организме (NаНС03 - щелочной резерв крови - компонент гидрокарбонатной буферной системы), перенос аминокислот и cахаров через клеточную мембрану. Ионы Nа+ и К+ активируют аденозинтрифосфатазу клеточных мембран, которая «включает» ионы Nа+ из клетки и обеспечивает сопряженное накопление ионов К+ в ней. Различные концентрации двух данных ионов по разные стороны от мембраны обусловливают возникновение трансмембранной разности потенциалов (до 100 мВ), что обеспечивает существование легкодоступного источника энергии для многих связанных с функционированием мембран процессов. Ионы Nа+ и К+ оказывают существенное влияние на деятельность центральной нервной системы (ЦНС). Так, избыток ионов Nа+ в клетках коры головного мозга вызывает депрессию, т.е. угнетение деятельности ЦНС. Наоборот, избыток ионов К+ в клетках коры головного мозга вызывает маниакальное состояние, т.е. возбуждение деятельности ЦНС.
В практике применяются: 1. Хлорид натрия NаС1. В зависимости от его концентрации различают изотонический (физиологический) и гипертонический растворы. Изотоническим является 0,9 %-ный раствор NаС1, так как его осмотическое давление соответствует осмотическому давлению плазмы крови (780,2 кПа). Изотонический раствор применяют в качестве плазмо-замещающего раствора при обезвоживании организма, для растворения лекарственных веществ и т.д. Гипертонические растворы (с массовой долей NаС1 3, 5 и 10 %) применяют наружно в виде компрессов и примочек для лечения гнойных ран. 2. Гидрокарбонат натрия NаНС03 (питьевая сода). Введение гидрокарбоната натрия в желудок приводит к быстрой нейтрализации соляной кислоты желудочного сока и поэтому рассматривается как антацидное средство. Применяют в порошках, таблетках и растворах при повышенной кислотности желудочного сока, язвенной болезни желудка и двенадцатиперстной кишки: NаНС03 + НС1 = NаС1 + Н20 + С02. 3. Декагидрат сульфата натрия Nа2S04 • 10Н2О (глауберова соль). Назначают внутрь в качестве слабительного средства. 4. Декагидрат тетрабората натрия Nа2В407 • 10Н2О (бура). Применяют наружно как антисептическое средство для спринцеваний, полосканий, смазываний, В водных растворах бура легко подвергается гидролизу: Nа2В407 + 7Н20 = 4Н3В03 + 2 NаОН. Образующаяся при гидролизе борная кислота обладает антисептическим действием. 5. Йодид натрия NаI. Используют как препарат йода при эндемическом зобе. 6. Хлорид калия КС l. Применяют при состояниях, сопровождающихся нарушением электролитного обмена в организме (неукротимая рвота, профузные поносы), а также для купирования сердечных аритмий. 7. Йодид калия К I. Применяют как препарат йода при заболеваниях щитовидной железы. 8. Перманганат калия КМ n04. Используют как антисептическое средство для промывания ран, полоскания рта и горла, для спринцеваний и промываний. 9. Водный раствор аммиака, гидроксид аммония (нашатырный спирт) NH4ОН. Используют для возбуждения дыхания и выведения больных из обморочного состояния, для чего небольшой кусок ваты или марли, смоченной в нашатырном спирте, осторожно подносят к носовым отверстиям. 10. Хлорид аммония (нашатырь) NH4С1. Оказывает отхаркивающее действие, усиливает мочеотделение. Свинец. Биологическая роль свинца не установлена. Его соединения токсичны. У рабочих различных производств, связанных с получением и применением свинца, могут встречаться явления острого и хронического отравления (сатурнизм). При сатурнизме наблюдается ряд симптомов поражения ЦНС (головная боль, бессонница, судороги, галлюцинации, атрофия зрительного нерва), а также нарушения функции почек (альбуминурия) и желудочно-кишечного тракта («свинцовые колики»). В медицине соединения свинца применяются только наружно как антисептические и вяжущие средства. Оксид свинца РЬО входит в состав свинцового пластыря, используемого при воспалительных заболеваниях кожи, фурункулезе.Добавки свинца используют при изготовлении одежды для медперсонала рентгеновских кабинетов (фартуки, рукавицы, шлемы), так как свинец поглощает рентгеновские лучи. Серебро. Физиологическая роль серебра в живом организме изучена недостаточно. Серебро относится к ультра микроэлементам. Это означает, что оно находится в организме в концентрации менее 10-12 %. В медицине применяются: 1. Нитрат серебра А gNO3 (ляпис) - вяжущее и прижигающее средство, используется наружно. Применяется в стоматологии для серебрения корневых каналов и кариозных полостей зубов перед их пломбированием. Сначала из нитрата серебра получают аммиачный раствор оксида серебра, затем добавляют водный раствор формальдегида с его массовой долей 10 %. Образующаяся серебряная пленка посылает в окружающее пространство ионы серебра, которые обладают бактерицидным действием. 2. Нитрат и хлорид серебра применяются для пропитки перевязочного материала - бумаги, ваты, марли. Ртуть. Ртутное заражение почвы, природных вод, растений и животных в настоящее время характерно для многих регионов планеты. Оно связано с поступлением в биосферу большого количества ртути в виде продуктов промышленного производства, выхлопов транспорта, ядохимикатов. Ртуть накапливается главным образом в печени и почках. При хроническом отравлении ртутью и ее соединениями («меркуризм») появляются металлический привкус во рту, сильное слюнотечение, слуховые и обонятельные галлюцинации, головные боли, наблюдается ослабление памяти.
Применяются в медицине: 1. Желтая ртутная мазь - оксид ртути (II). Используется для лечения кожных заболеваний. 2. Хлорид ртути (II) Н gС12 (сулема). Обладает высокой токсичностью, при работе с ней необходимо соблюдать большую осторожность; растворы в разведении 1:1000 применяются для дезинфекции белья, предметов ухода за больными, помещений, медицинского инструментария. В медицине используют не только соединения, но и саму ртуть и ее пары (ртутные термометры, ртутные манометры в аппаратах для измерения кровяного давления).Ультрафиолетовые лучи, полученные от ртутно-кварцевых ламп, глубоко прогревают ткани, губительно действуют на многие микроорганизмы. II. Контроль исходного уровня знаний 1. Фронтальный опрос по качественным реакциям (Приложение 1). 2. Индивидуальный письменный опрос. Задания на карточках. Написать качественные реакции на предложенный катион III. Самостоятельная работа Вводный инструктаж. Выполнить качественные и групповые реакции на катионы 1 и 2 аналитических групп. (Приложение 2). Результаты работы оформить в тетради в виде таблицы. Перед проведением химических реакций необходимо помнить о технике безопасности в химической лаборатории. Работа проводится индивидуально.
IV. Закрепление пройденного материала. Выполнение анализа смеси катионов 1 и 2 аналитических групп (приложение 3). V. Подведение итогов занятия. VI .Задание на дом. Тема: «Качественные реакции катионов 3 и 4 аналитических групп». Вопросы для самоподготовки: 1. Действие группового реактива катионы 3 и 4 аналитических групп. 2. Качественные реакции катионов 3 и 4 аналитических групп. Приложение 1 Фронтальный опрос. 1. Назвать методы качественного анализа по количеству анализируемого вещества и реагента. 2.. Назвать методы качественного анализа по агрегатному состоянию реагирующих веществ. 3. Перечислить классификацию реактивов по их чистоте. 4. Дать характеристику кислотно-основной классификации катионов. 5. Перечислить катионы 1 аналитической группы. Назвать групповой реактив. 6.Перечислить катионы 1 аналитической группы. Назвать групповой реактив. 7. Почему открытие катиона калия гидротартратом натрия должно проводиться в нейтральной среде? Написать уравнение реакций. 8.Почему осаждение катиона Na в виде дигидроантимоната натрия должно проводиться в нейтральной, а не в кислой или щелочной среде? 9. Почему перед открытием катиона К необходимо удалить катион NH4 +? 10. При действии группового реагента на катионы второй группы получаются осадки – хлориды соответствующих катионов: AgCl, Hg2Cl2, PbCl2. Какова растворимость хлоридов в воде и как это используется в анализе? Приложение 2.
Катионы 1 аналитической группы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. | NH 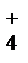
| NaOH или КОН | 2-3 капли раствора NH4Cl поместите в пробирку, прибавьте 3-4 капли щелочи, нагрейте | Выделяется газообразный аммиак характерного запаха, влажная лакмусовая бумажка синеет. | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. | NH 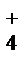
| Реактив Несслера K2[HgJ4]+KOH | Каплю раствора аммония поместите на предметное стекло, свержу нанесите каплю раствора Несслера | Образуется кирпично-красный осадок. Реакция высокочувствительна. | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. | K+ | Гидротартрат натрия или винная кислота NaHC4H4O6 или H2C4H4O6 | В пробирку поместите 5 капель соли калия, прибавьте 5 капель кислоты, перемешайте содержимое стеклянной палочкой. | Выпадает белый кристаллический осадок. | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. | К+ | гексанитрокобальтат (III) натрия Na3[Co(NO2)6] | К капле раствора калия прибавьте 5 капель винной кислоты, перемешайте содержимое стеклянной палочкой. | Выпадает белый кристаллический осадок. | ||||||||||||||||||||||||||||||||||||||||||||||||
| 5. | К+ | Пламя | Нихромовую проволоку опустите в концентрированную соляную кислоту, внесите в пламя спиртовки, нагрейте до раскаления. Чистую проволоку опустите в раствор или сухую соль калия, внесите в бесцветную часть пламени. | Пламя окрашивается в фиолетовый цвет. | ||||||||||||||||||||||||||||||||||||||||||||||||
| 6. | К+ | Гексанитро (II) купрат натрия свинца Na2Pb[Cu(NO2)6] | На предметное стекло поместите 1 каплю раствора соли калия, выпарьте досуха на пламени горелки, нанесите сверху каплю реагента. | Образуются кубические кристаллы. | ||||||||||||||||||||||||||||||||||||||||||||||||
| 7. | Na+ | Дигидроантимонат калия KH2SbO4 | К 5 каплям соли натрия прибавьте 5 капель раствора дигидроантимоната калия. потрите стеклянной палочкой о стенки пробирки. | Выпадает белый кристаллический осадок. | ||||||||||||||||||||||||||||||||||||||||||||||||
| 8. | Na+ | Уранилацетат UO2(CH3COO)2 | Каплю раствора соли натрия поместите на предметное стекло, выпарьте досуха, нанесите каплю уранилацетата. | Образуются кристаллы тетраэдрической или октаэдрической формы. | ||||||||||||||||||||||||||||||||||||||||||||||||
| 9. | Na+ | Пламя | Чистую нихромовую проволоку окуните в соль или раствор соли натрия, внесите в бесцветную часть пламени. | Пламя окрашивается в желтый цвет. | ||||||||||||||||||||||||||||||||||||||||||||||||
| Катионы II аналитической группы
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 280; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.142.115 (0.06 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||



