Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Состав белка. Малые органические молекулы-аминокислоты, их строение, основные свойства. Причины разнообразия белков.Содержание книги
Поиск на нашем сайте
Преподаватель: Для раскрытия природы белка изучим его химические свойства. Белки не удавалось выделить из костной ткани, хрящей, волос, копыт, так как они не переносят нагревания и кристаллизации из горячих растворов. Поэтому вначале занимались изучением не структуры белка, а химического состава. В белке содержатся следующие химические элементы: С, Н, О, N, S, P, Fe, и др. Массовая доля элементов: С -55%, О – 24%, Н – 7,3%, N – 19%, S -2,4%. На долю белков приходится более 50% общей массы органических соединений животной клетки: в мышцах – 80%, в коже – 63%, в печени – 57%, в мозге – 45%, в костях -28% Мономером белка являются аминокислота. Всего известно 150 аминокислот, в состав живого входит – 20 аминокислот. Они получили название "волшебных", их список представлен в таблице (см. приложение Б). Среди аминокислот есть заменимые, они могут синтезироваться в организме и незаменимые. Незаменимые, которые в организме не образуются, их получают с пищей (лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, тирозин, метионин). Органические вещества в природе представляют собой биополимеры (пенициллин – С16Н18О4N2, молоко – С1864Н3021О576N466S21, гемоглобин–С3032Н4876О872N780S6Fе4) состоящие из мономеров. Итак, белки это - макромолекулы, биополимеры, полипептиды. Белки - это самые сложные молекулы. Белки разного размера включают в себя от нескольких десятков до нескольких сотен и даже тысяч аминокислот. В среднем длина белка 300 аминокислот. Если в состав этого белка входят 12 из 20 важнейших аминокислот, то число возможных изомеров для этого белка оказывается равным 10300. Причины разнообразия белков. Решите задачу: сколькими способами можно нанизать на нитку длиной в 100 бусин бусины 20 цветов (студенты решают задачу, используя калькулятор). Ответ: получается число со 130 нулями, представить такое число невозможно.
Строение и Структуры белка. Самостоятельная работа студентов с учебным материалом, задание: используя, параграф 3 и рисунки учебника, изучите строение аминокислот: 1. Сравните строение аминокислот, найдите черты сходства и различия. 2. Как из 20 аминокислот получаются миллионы белковых молекул? 3. Что произойдет со свойствами белка, если изменить последовательность аминокислотных звеньев в линейной полимерной цепи? Как эти изменения отразятся на организме?
4. С помощью рисунка 3 на странице 22 параграфа 3 разберитесь, как образуется пептидная связь. Почему белки по - другому называют пептидами? Обсуждение самостоятельной работы. Преподаватель: Исследования показали, что в укладке пептидной цепи нет ничего случайного или хаотичного. Она свёртывается упорядоченно, для каждого белка определённым образом. Для того чтобы разобраться в замысловатой укладке белковой макромолекулы, следует рассмотреть в ней уровни организации.
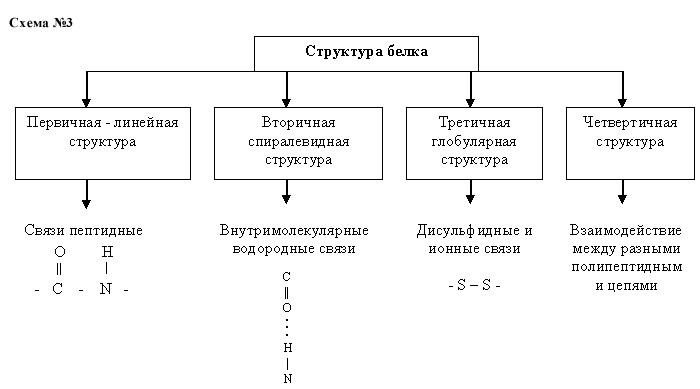
Беседа по изучению нового материала с применением постановки проблемных вопросов: 1. Какой единый принцип лежит в основе построения первичной структуры белка? Ожидаемый ответ: последовательность чередования различных аминокислотных звеньев вполипептидной цепи. 2. Что собой представляет вторичная структура белка? Какие связи стабилизируют вторичную структуру? Ожидаемый ответ: пространственная конфигурация белковой молекулы свернутые в виде спирали. В формировании и поддержании плотной спиральной конфигурации полипептидной цепи играют роль водородные связи между –С=О и –N–H группами. 3. Что собой представляет третичная структура белка? Ожидаемый ответ: третичная структура отражает расположение полипептидной цепи в пространстве, это конфигурация, которую принимает в пространствезакрученная вспираль полипептидная цепь. Она поддерживается взаимодействием разных функциональных групп полипептидной цепи. Так, между атомами серы образуется дисульфидный мостик, между карбоксильной и гидроксильной группами имеется сложноэфирный мостик, а между карбоксильной и аминогруппами может возникнуть солевой мостик. Для этой структуры характерны и водородные связи). 4. Какую роль выполняют радикалы в третичной структуре?Ожидаемый ответ: полярные, гидрофильные R-радикалы выступая наружу глобулы, обеспечивают специфическую биологическую активность белка. 5. Что собой представляет четвертичная структура белка? Ожидаемый ответ: некоторые белковые макромолекулы могут соединяться друг с другом и образовывать относительно крупные агрегаты. Самостоятельная работа студентов, задание:заполнить схему:
Преподаватель: Как можно с помощью проволоки, бус показать образование вторичной, третичной, четвертичной структур белка. За счет каких связей, взаимодействий это происходит? (студенты демонстрируют выполнение раннее полученного задания сделать структуры белка) Свойства белков. При рассмотрении вопроса преподаватель использует элементы беседы, проводит работу над формированием понятий Преподаватель: Физические свойства. Свойства белков так же разнообразны, как и функции, которые они выполняют. Одни белки растворяются в воде, образуя, как правило, коллоидные растворы (например, белок яйца); другие растворяются в разбавленных растворах солей; третьи нерастворимы (например, белки покровных тканей). Для белков характерна различная окраска: белая, красная (гемоглобин), синяя (гемоциан), чёрная (меланин), бесцветная. Для белков характерно амфотерные свойства. Под воздействием физико-химических факторов структура белка может изменяться (денатурация, ренатурация, деструкция). Физико-химические свойства: Для белков характерны реакции, в результате которых выпадает осадок. Но в одних случаях полученный осадок при избытке воды растворяется, а в других – происходит свертывание белков, т.е. денатурация. Ренатурация – это процесс обратный денатурации. К чему может привести денатурация? - нарушение антигенной чувствительности белка; - блокирование ряда иммунологических реакций; - нарушение обмена веществ; - воспаление слизистой оболочки ряда органов пищеварения (гастриты, колит); - камнеобразование (камни имеют белковую основу). В основе раздражимости живых организмов лежит способность белков к денатурации и ренатурации. В этом заключается сигнальная функция белка. На поверхностной мембране клетки располагаются белки, способные изменять свою структуру в ответ на действие различных факторов, так воспринимаются и передаются сигналы в клетку. Фибриноген (Р) под действием ферментов превращается в фибрин (Н) (деструкция). Паук выделяет капельку секрета (фиброин) и прикрепляет её к опоре. Затем ниточка натягивается и этого достаточно, чтобы из растворимой формы он перешёл в нерастворимую (Деструкция). Денатурация белка может происходить под влиянием различных факторов: температуры, кислоты, щелочи, солей, и т.д. Процесс денатурации легче пронаблюдать у белков, растворимых в воде. Примером может служить денатурация белка куриного яйца. Также для белков свойственно такое явление как гидролиз. Гидролиз белка – это, прежде всего разрушение одного из важнейших уровней организации белковой молекулы - первичной структуры под действием кислот, щелочей или ферментов, приводящее к образованию α- аминокислот, из которых он был составлен.
|
||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 169; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.73.198 (0.01 с.) |