
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обработка результатов измеренийСодержание книги
Поиск на нашем сайте
1. Зная U ИП i и UR i, для каждого измерения определить U i - падение напряжения на нагревателе. 2. Зная U i и R, определить для каждого измерения силу тока I i в цепи нагревателя на основе закона Ома для участка цепи, записать значения U i и I i в таблицу 1. 3. Рассчитать по формуле (11) значения коэффициента теплопроводности ki для каждого измерения. Полученные данные занести в таблицу 2.
Таблица 2
4. Определить абсолютную D k и относительную e ошибки в измерении коэффициента теплопроводности воздуха методом обработки результатов прямых измерений.
КОНТРОЛЬНЫЕ ВОПРОСЫ ДЛЯ ДОПУСКА К РАБОТЕ 1. Какова цель работы? 2. Рассказать порядок выполнения работы. 3. Какие данные наблюдаются на экране монитора? 4. Как определить U - падение напряжения на нагревателе и I - силу тока в цепи нагревателя? 5. При каких положениях переключателя на источнике питания производятся измерения?
ОНТРОЛЬНЫЕ ВОПРОСЫ ДЛЯ СДАЧИ РАБОТЫ 1. Назвать, какие явления переноса наблюдаются в термодинамических неравновесных системах? Переносом каких величин обусловлены эти явления? 2. Записать и сформулировать закон Фика для явления диффузии. Дать определения величинам, входящим в формулу. 3. Записать и сформулировать закон Ньютона для внутреннего трения (вязкости). Дать определения величинам, входящим в формулу. 4. Записать и сформулировать закон Фурье для теплопроводности. Дать определения величинам, входящим в формулу. 5. Каков механизм явлений переноса? 6. Записать, по какой формуле определяются коэффициенты диффузии, вязкости, теплопроводности? 7. Записать формулы, устанавливающие зависимости между коэффициентами переноса. 8. Каков физический смысл коэффициентов переноса? 9. Объяснить физический смысл знака (-) в законах Фика, Фурье, Ньютона. 10. Вывести формулу (11). 11. Провести анализ полученного значения коэффициента теплопроводности.
ЛАБОРАТОРНАЯ РАБОТА № 1-17
ИЗУЧЕНИЕ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА Цель работы: изучить изопроцессы и описывающие их газовые законы; определить массу воздуха и измерить температуру воздуха в закрытом сосуде при изотермическом процессе.
ВВЕДЕНИЕ В основе изучения свойств макроскопических тел и тепловых процессов, протекающих в них, лежит молекулярно-кинетическая теория. В молекулярно-кинетической теории газов пользуются моделью идеального газа, согласно которой считают, что: 1) собственный объём молекул газа пренебрежимо мал по сравнению с объёмом сосуда; 2) между молекулами газа отсутствуют силы взаимодействия; 3) столкновения молекул газа между собой и со стенками сосуда - абсолютно упругие. Модель идеального газа можно использовать при изучении реальных газов, находящихся в условиях, близких к нормальным. В этом случае по своим свойствам реальные газы близки к идеальному газу, в том числе и воздух. Рассмотрим законы, описывающие поведение идеальных газов. Закон Бойля-Мариотта (1662 г, 1676 г): для данной массы газа m при постоянной температуре T произведение давления газа P на его объём V есть величина постоянная:
Кривая, изображающая для указанного случая зависимость между P и V, называется изотермой, а рассматриваемый процесс называется изотермическим. Закон Гей-Люссака (1802 г): объём данной массы газа V при постоянном давлении P изменяется линейно с температурой t:
На диаграмме в координатах V, t этот процесс изображается прямой, называемой изобарой, а рассматриваемый процесс называется изобарным. Закон Шарля (1787 г): давление P данной массы газа при постоянном объёме V изменяется линейно с температурой t:
На диаграмме в координатах, P, t этот процесс изображается прямой, называемой изохорой, а рассматриваемый процесс –изохорным. После введения шкалы Кельвина (1848 г) законы Гей-Люссака и Шарля принято записывать следующим образом: Состояние некоторой массы газа m определяется тремя основными термодинамическими параметрами: давлением Р, объёмом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния. Клапейрон (1834 г) вывел уравнение состояния идеального газа, объединив газовые законы: В 1874 г. Менделеев получил уравнение газового состояния для одного моля в виде: Здесь
и носит название – уравнение Менделеева - Клапейрона.
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 158; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.185.207 (0.006 с.) |

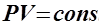 , при
, при 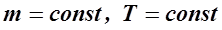 . (1)
. (1)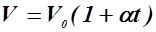 , при
, при 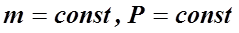 . (2)
. (2)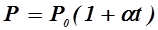 , при
, при 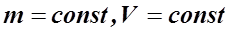 . (3)
. (3)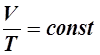 , при
, при 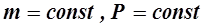 . (21)
. (21)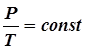 , при
, при 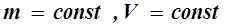 . (31)
. (31)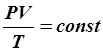 . (4)
. (4)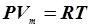 . (5)
. (5)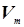 - молярный объём газа,
- молярный объём газа, 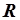 - универсальная газовая постоянная. Уравнение состояния для произвольной массы газа записывается следующим образом:
- универсальная газовая постоянная. Уравнение состояния для произвольной массы газа записывается следующим образом: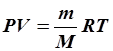 (6)
(6)


