Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кафедра химии и фармацевтической технологииСодержание книги Поиск на нашем сайте
ФАРМАЦЕВТИЧЕСКИЙ ФИЛИАЛ ГБОУ СПО «СВЕРДЛОВСКИЙ ОБЛАСТНОЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ» Кафедра химии и фармацевтической технологии
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Учебное пособие для самостоятельной работы студентов по учебной дисциплине «Общая и неорганическая химия»
Екатеринбург 2012 Пособие для самостоятельной работы студентов по общей и неорганической химии / сост. преподаватель химии, кандидат химических наук А.И. Серебрякова. – Екатеринбург; Фармацевтический филиал ГБОУ СПО «СОМК», 2012. – 34 с.
Рецензент: Л.И. Русинова доцент УГТУ - УПИ, кандидат химических наук
Учебное пособие предназначено для самостоятельной работы студентов. Пособие содержит два раздела. В первом разделе рассматривается классификация, номенклатура, свойства неорганических соединений. Приведены примеры веществ различных классов, даны задания для самостоятельной работы. Второй раздел посвящен сложным веществам координационного строения – комплексным соединениям, которые широко используются в качестве аналитических реагентов в фармацевтическом анализе. Данное пособие позволяет повторить материал о классах соединений и подготовиться изучению учебной дисциплине Аналитическая химия и ПМ 02 МДК 02.02. «Контроль качества лекарственных средств».
Учебное пособие рассмотрено на заседании кафедры химии и фармацевтической технологии (протокол № 2 от 07 сентября 2012 года)
СОДЕРЖАНИЕ I.Основы классификации неорганических соединений 5 I.1. Простые вещества 5 I.2. Сложные вещества 5 I.2.1. Оксиды 5 I.2.1.1. Номенклатура оксидов 6 I.2.1.2. Физические свойства оксидов 6 I.2.1.3. Получение оксидов 6 I.2.1.4. Химические свойства оксидов 7 I.2.2. Гидроксиды 7 I.2.2.1. Кислоты (кислотные гидроксиды) 9 I.2.2.1.1. Физические свойства кислот 9 I.2.2.1.2. Получение кислот 9 I.2.2.1.3. Химические свойства кислот 9 I.2.2.2. Основания (основные гидроксиды) 10 I.2.2.2.1. Физические свойства оснований 10 I.2.2.2.2. Получение оснований 11 I.2.2.2.3. Химические свойства 11 I.2.2.3. Амфотерные гидроксиды 11 I.2.2.3.1. Химические свойства амфотерных гидроксидов 12 I.2.3. Соли 15 I.2.3.1. Средние или нормальные соли 15 I.2.3.1.1. Получение средних солей 15 I.2.3.1.2. Химические свойства средних солей 16 I.2.3.2. Кислые соли 16 I.2.3.2.1. Получение кислых солей 16 I.2.3.2. Основные соли 16 I.2.3.2.1. Получение основных солей 17 I.2.3.3. Смешанные соли 19 I.2.3.4. Двойные соли 19 I.2.3.5. Комплексные соли 19 II. Комплексные соединения 20 II.1. Понятие и определение 20 II.2. Классификация 21 II.3. Координационное число 21 II.4. Строение комплексного иона с точки зрения электронного строения комплексообразователя 22 II.5. Определение заряда комплексообразователя и комплексного иона 23 II.6. Номенклатура 23 II.6.1. Номенклатура комплексных соединений катионного типа 23 II.6.2. Номенклатура комплексных соединений анионного типа 24 II.7. Диссоциация комплексных соединений 25 II.8. Получение некоторых комплексных соединений 26 II.9. Значение и применение комплексных соединений 27 II.10. Кристаллогидраты солей, как комплексные соединения 28 II.11. Двойные соли, как комплексные соединения 28 Приложение 29 Список рекомендуемой литературы 37
II. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ II.1. Понятие и определение. Комплексные соединения – наиболее многочисленный класс неорганических соединений. Дать краткое и исчерпывающее определение этим соединениям трудно. Комплексные соединения также называют координационными. В химии координационных соединений переплетаются органическая и неорганическая химия. До конца XIX века изучение комплексных соединений носило чисто описательный характер. 1893 год швейцарский химик Альфред Вернер создал координационную теорию. Суть ее заключается в следующем: в комплексных соединениях имеется правильное геометрическое размещение атомов или групп атомов, называемых лигандами или аддендами, вокруг центрального атома – комплексообразователя. Таким образом, химия комплексных соединений изучает ионы и молекулы, состоящие из центральной частицы и координированных вокруг нее лигандов. Центральная частица – комплексообразователь и непосредственно связанные с ней лиганды, образуют внутреннюю сферу комплекса. Для неорганических лигандов, чаще всего, число их совпадает с координационным числом центральной частицы. Таким образом, координационное число – это общее число нейтральных молекул или ионов (лигандов), связанных с центральным атомом в комплексе Ионы, находящиеся за пределами внутренней сферы, образуют внешнюю сферу, комплексного соединения. В формулах внутреннюю сферу заключают в квадратные скобки. лиганды
K4 [Fe(CN)6] [Fe(CN)6]4- - внутренняя сфера или комплексный ион
ион-комплексообразователь координационное число Комплексообразователями служат: 1) положительные ионы металлов (чаще d-элементы): Ag+, Fe2+, , Fe3+, Cu2+, Al3+, Co3+; и др. (ионы- комплексообразователи). 2) реже - нейтральные атомы металлов, относящиеся к d-элементам: (Сo, Fe, Mn и др.) 3) некоторые атомы неметаллов с различной положительной степенью окисления - B+3, Si+4, P+5 и др. Лигандами могут быть: 1) отрицательнозаряженные ионы (OH-, Hal -, CN - -цианогруппа, SCN- - тиоцианогруппа, NH2- -аминогруппа, и др.) 2) полярные молекулы: H2O (название лиганда - «аква»), NH3 («аммин»), CO («карбонил»). Таким образом, комплексными соединениями (координационными соединениями) называются сложные химические соединения, в составе которых имеются комплексные ионы, образованные центральным атомом в определенной степени окисления (или с определенной валентностью) и связанными с ним лигандами.
II.2. Классификация I. По характеру лигандов: 1. Аквакомплексы (H2O) 2. Гидроксокомплексы (OH) 3. Амминкомплексы (NH3) - аммиакаты 4. Ацидокомплексы (с кислотными остатками - Сl-, SCN-, S2O32- и другие) 5. Карбонилкомплексы (СО) 6. Комплексы с органическими лигандами (NH2-CH2-CH2-NH2 и др.) 7. Анионгалогенаты (Na [I Cl4]) 8. Аминокомплексы (NH2) II. По заряду комплексного иона: 1. Катионного типа - заряд комплексного иона - положительный 2. Анионного типа - заряд комплексного иона - отрицательный.
Для правильного написания комплексного соединения необходимо знать степень окисления центрального атома, его координациооное число, природу лигандов и заряд комплексного иона.
II.3. Координационное число можно определить как число σ - связей между нейтральными молекулами или ионами (лигандами) и центральным атомом в комплексе. Величина координационного числа определяется, главным образом, размерами, зарядом и строением электронной оболочки комплексообразователя. Наиболее часто встречается координационное число 6. Оно характерно для следующих ионов: Fe2+, Fe3+, Co3+, Ni3+, Pt4+, Al3+, Cr3+, Mn2+, Sn4+.
K3[Fe(CN)6], Na3[Co(NO2)6], [Cr(H2O)6] Cl3 гексацианоферрат (Ш) гексанитрокобальтат(Ш) гексааквахрома (Ш)хлорид калия натрия
Координационное число 4 встречается у 2-хзарядных ионов и у алюминия или золота: Hg2+, Cu2+, Pb2+, Pt 2+, Au3+ , Al3+. [Cu(NH3)4] (OH)2 - тетрааммин меди(II) гидроксид; Na2[Cu(OH)4 ] – тетрагидроксокупрат (II) натрия K2 [HgI4] – тетраиодомеркурат (II) калия; H[AuCl4] – тетрахлороаурат(III) водорода. Часто координациооное число определяется как удвоенная степень окисления иона-комплексообразователя: у Hg2+, Cu2+, Pb2+ - координационное число равно 4; у Ag+, Cu+ - координационное число равно 2. Для определения, расположения иоов во внутренней или внешней сфере нужно провести качественные реакции. Например, у K3[Fe(CN)6] -гексацианоферрата(III) калия. Известно, что ион железа (+3) образует с роданид (тиоционат)- анионом роданид железа (+3) темно-красного цвета. Fe3+ +3 NH4 SCN à Fe (SCN)3 + 3NH4+ При добавлении раствора роданида аммония или калия к раствору гексацианоферрата(III) калия окраски не наблюдается. Это говорит об отсутствии ионов железа Fe3+ в растворе в достаточном количестве. Центральный атом связан с лигандами ковалентной полярной связью (донорно-акцепторный механизм образования связи), поэтому реакция ионного обмена не идет. Наоборот, внешняя и внутренняя сферы связаны ионной связью.
II.4. Строение комплексного иона с точки зрения электронного строения комплексообразователя. Разберем строение катиона тетраамминмеди (II): а) электронная формула атома меди:
2 8 18 1 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
4s1 б) электронная формула катиона Cu2+:
4so :NH3 :NH3 : NH3: NH3
CuSO4 + 4: NH3 -à [Cu(NH3)] SO4
[Cu(NH3)] SO4 à [Cu(NH3)4 ]2+ + SO42-
ионная связь ков. связь по донорно- акцепторному механизму.
Упражнение для самостоятельного решения: Изобразите строение комплексного иона [Fe(CN)6]3- по алгоритму: а) напишите электронную формулу атома железа; б) напишите электронную формулу иона железа Fe3+, убрав электроны с 4s подуровня и 1 электрон с 3d- подуровня; в) перепишите электронную формулу иона еще раз, переведя электроны 3d- подуровня в возбужденное состояние путем их спаривания в ячейках этого подурвня г) подсчитайте число всех свободных ячеек на 3d, 4s, 4p - подуровнях д) расположите под ними цианид-анионы CN- и проведите стрелки от ионов к пустым ячейкам.
II.5. Определение заряда комплексообразователя и комплексного иона: 1.Заряд комплексного иона равен заряду внешней сферы с обратным знаком; он также равен сумме заряда комплексообразователя и всех лигандов. +2 -1 х K2[HgI4] +2+ (- 1) ·4 =х х = -2
2. Заряд комплексообразователя равен алгебраической сумме зарядов лигандов и внешней сферы (с обратным знаком). х 0 -1 [Ag(NH3)2] Cl х +0·2 +(–1)·2 = 0; х=2-1= +1 х 0 2- [Cu(NH3)4] SO4 х+ 4· 0 -2 = 0 х = +2 3.Чем больше заряд центрального атома и меньше заряд лиганда, тем больше координационное число.
II.6. Номенклатура. Существует несколько способов названий комплексных соединений. Выберем более простой с использованием валентности (или степени окисления) центрального атома II.6.1. Название комплексных соединений катионного типа: Комплексные соединения относятся к катионному типу, если заряд комплексного иона положительный. При названии комплексных соединений: 1) сначала называется координационное число с помощью греческих приставок (гекса, пента, три); 2) затем, заряженные лиганды с добавлением окончания «о»; 3) затем, нейтральные лиганды (без окончания «о»); 4) комплексообразователь на русском языке в родительном падеже, указывается его валентность или степень окисления и после этого называется анион. Аммиак – лиганд называется «аммин» без «о», вода –«аква» Примеры: [Cu(NH3)4] SO4 тетрааммин меди (II) сульфат; [Ag(NH3)2] Cl диаммин серебра (I) хлорид; [CoI6] Cl3 – гексаиодокобальта (Ш) хлорид; [Al(C2O4)(H2O)5] Cl – оксалатопентаакваалюминия(Ш) хлорид (окалат - двухзарядный анион щавелевой кислоты); [Fe(H2O)6]Cl3 –гексаакважелеза(Ш) хлорид.
II.6.2. Номенклатура комплексных соединений анионного типа. Называется катион, координационное число, лиганды и, затем, комплексообразователь - центральный атом. Комплексообразователь называется на латинском языке в именительном падеже с окончанием «ат». Примеры: K3[FeF6] – калия гексафтороферрат(Ш); Na3[Co(NO2)6] – натрия гексанитрокобальтат (III); NH4 [Hg(CO)2 (SCN)2] –аммония дитиоцианодикарбонил меркуриат (I)
Нейтральный комплекс: [Fe(CO)5] – пентакарбонил железо.
ПРИМЕРЫ И ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
Пример 1. Классифицировать, полностью охарактеризовать и дать названия следующим комплексным соединениям: а) K 3 [ Ag (SO 3 S)2] –; б) [ Co (NH 3)4 Cl 2 ] Cl; в) [ W (CO)6]. Решение и ответ: а) 1) K3[Ag(SO3S)2] - 3 иона К+ - внешняя сфера, ее общий заряд +3, [Ag(SO3S)2]3- - внутренняя сфера, ее общий заряд равен заряду внешней сферы, взятому с противоположным знаком - (3-) 2) Комплексное соединение анионного типа, так как заряд внутренней сферы - отрицательный; 3) Центральный атом - комплексообразователь - ион серебра Ag+ 4) Лиганды - два двухзарядных остатка тиосерной кислоты H2S2O3, относится к ацидокомплексам 5) Координационное число комплексообразователя в данном случае как исключение равно 4 (у двух остатков кислоты 4 валентных σ - связи без 4-х катионов водорода); 6) Заряд комплексообразователя равен +1: +1 х -2 0 K3[Ag(SO3S)2]: +1 · 3 + Х + (-2) · 2 = 0 à X= +1 23 7) Название: – калия дитиосульфатоаргентат (I).
б) 1) [Co(NH3)4Cl2]Cl - 1 ион - Сl- - внешняя сфера, ее общий заряд -1, - [Co(NH3)4Cl2] - внутренняя сфера, ее общий заряд равен заряду внешней сферы, взятому с противоположным знаком - (3+) 2) Комплексное соединение катионного типа, так как заряд внутренней сферы - положительный. 3) Центральный атом - комплексообразователь - ион кобальта Со, вычисляем его заряд: х 0 -1 1+ [Co(NH3)4Cl2]: Х + 0 · 4 + (-1) · 2 = +1 à Х = 0 +2 +1 = +3 4) Комплексное соединение смешанного типа, так как в его составе разные лиганды; ацидокомплекс (Cl-- остаток хлороводородной кислоты) и амминкамплекс - аммиакатный (NH3 - аммиак-нейтральное соединение) 5) Координационное число комплексообразователя равно 6; 6) Название – дихлоротетраамминкобальта(III) хлорид.
в) 1) [W(CO)6] - внешней сферы нет 2) Комплексное соединение нейтрального типа, так как заряд внутренней сферы = 0. 3) Центральный атом - комплексообразователь - атом вольфрама, его заряд =0 4) Карбонилкомплекс, так как лигандом является нейтральная частица - карбонил - СО; 5) Координационное число комплексообразователя равно 6; 6) Название: – гексакарбонилвольфрам
Задание 1. Охарактеризуйте комплексные соединения: а) Li 3 Cr (OH)6] б) [ Zn (H 2 O)3 F] I 2 в) [ Pt Cl 2 (NH 3)2] и дайте им названия. Задание 2. Назовите комплексные соединения: [ Co (NH 3)4(NO 2)2] NO 3, K 3 [ Al (C 2 O 4)3 ], Na 3 [ Co (NO 2)6], H [ AuCl 4 ], Fe3[ Cr (CN)6]2
ПРИЛОЖЕНИЕ Названия некоторых лигандов
Таблица растворимости неорганических соединений
Ряд напряжений металлов Группы элементов | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| I | II | III | IV | V | VI | VII | VIII | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| I | 1 | 1 H водород 1,00797 | (Н) | 2 Не гелий 4,0026 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| II | 2 | 3 Li литий 6,939 | 4 Ве бериллий 9,012 | 5 В бор 10,811 | 6 С углерод 12,01115 | 7 N азот 14,007 | 8 О кислород 15,9994 | 9 F фтор 18,998 | 10 Ne неон 20,179 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| III | 3 | 11 Na натрий 22,990 | 12 Mg магний 24,312 | 13 Al алюминий 26,982 | 14 Si кремний 28,086 | 15 Р фосфор 30,974 | 16 S сера 32,064 | 17 Cl хлор 35,453 | 18 Ar аргон 39,948 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IV | 4 | 19 К калий 39,102 | 20 Са кальций 40,08 | Sc 21 скандий 44,956 | Ti 22 титан 47,90 | V 23 ванадий 50,942 | Cr 24 хром 51,996 | Mn 25 марганец 54,938 | Fe26 Co 27 Ni 28 железо кобальт никель 55,847 58,993 58,71 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | Cu 29 медь 63,546 | Zn 30 цинк 65,37 | 31 Ga галлий 69,72 | 32 Ge германий 72,59 | 33 As мышьяк 74,922 | 34 Se селен 78,96 | 35 Br бром 79,904 | 36 Kr криптон 83,80 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| V | 6 | 37 Rb рубидий 85,47 | Sr стронций 87,62 | Y 39 иттрий 88,905 | Zr 40 цирконий 91,22 | Nb 41 ниобий 92,906 | Mo 42 молибден 95,94 | Tc 43 технеций [99] | Ru 44 Rh 45 Pd 46 рутений родий палладий 101,07 102,905 106,4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | Ag 47 серебро 107,868 | Cd 48 кадмий 112,40 | 49 In индий 114,82 | 50 Sn олово 118,69 | 51 Sb сурьма 121,75 | 52 Те теллур 127,60 | 53 I йод 126,904 | 54 Хе ксенон 131,30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| VI | 8 | 55 Cs цезий 132,905 | 56 Ва барий 137,34 | La * 57 лантан 138,91 | Hf 72 гафний 178,49 | Ta 73 тантал 180,948 | W 74 вольфрам 183,85 | Re 75 рений 186,2 | Os 76 Ir 77 Pt 78 осмий иридий платина 190,2 192,2 195,09 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | Au 79 золото 196,967 | Hg 80 ртуть 200,59 | 81 Tl таллий 204,383 | 82 Pb свинец 207,19 | 83 Bi висмут 208,98 | 84 Ро полоний [210] | 85 At астат [210] | 86 Rn радон [222] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| VII | 10 | 87 Fr франций [223] | 88 Ra радий [226] | Ac ** 89 актиний [227] | Ku 104 курчатовий [264] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Летучие водородные соединения | RH4 | RH3 | RH2 | RH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
* Лантаноиды
| 58 Се церий | 59 Pr празеодим | 60 Nd неодим | 61 Pm прометий | 62 Sm самарий | 63 Eu европий | 64 Gd гадолиний |
| 65 Tb тербий | 66 Dy диспрозий | 67 Ho гольмий | 68 Er эрбий | 69 Tm тулий | 70 Yb иттербий | 71 Lu лютеций |
** Актиноиды
| 90 Th торий | 91 Pa протактиний | 92 U уран | 93 Np нептуний | 94 Pu плутоний | 95 Am америций | 96 Cm кюрий |
| 97 Bk берклий | 98 Cf калифорний | 99 Es эйнштейний | 100 Fm фермий | 101 Md менделевий | 102 No нобелий | 103 Lr лоуренсий |
Кислотные оксиды
| Формула оксида | Формула кислоты | Название кислоты | Формула соли | Название соли | |
| В2О3 | H3BO3 HBO2 | Ортоборная Метаборная | Na3BO3 KBO2 Na2B4O7 | Ортоборат натрия Метаборат калия Тетраборат натрия | |
| CO2 | H2CO3 | Угольная | CaCO3 | Карбонат кальция | |
| SO2 | H2SO3 | Сернистая | Li2SO3 | Сульфит лития | |
| SO3 | H2SO4 | Серная | BaSO4 | Сульфат бария | |
| N2O3 | HNO2 | Азотистая | NaNO2 | Нитрит натрия | |
| N2O5 | HNO3 | Азотная |
| Нитрат натрия | |
| P2O3 | H3PO3 | Фосфористая | K3PO3 | Фосфит калия | |
| P2O5 | HPO3 H4P2O7 H3PO4 | Метафосфорная Пирофосфорная Ортофосфорная | LiPO3 Na4P2O7 Mg3(PO4)2 | Метафосфат лития Пирофосфат натрия Ортофосфат магния | |
| As2O5 | H3AsO4 | Мышьяковая | Ca3(АsO4)2 | Ортоарсенат кальция | |
| Cl2O | HClO | Хлорноватистая | NaClO | Гипохлорит натрия | |
| Cl2O3 | HClO2 | Хлористая | K ClO2 | Хлорит калия | |
| Cl2O5 | HClO3 | Хлорноватая | K ClO3 | Хлорат калия (бертолетова соль) | |
| Cl2O7 | HClO4 | Хлорная | Sr(ClO4)2 | Перхлорат стронция | |
| Mn2O7 | HMnО4↓ | Марганцевая | K Mn O4 | Перманганат калия | |
| MnO3 | - | - | K2Mn O4 | Манганат калия | |
| CrO3 | H2CrO4 H2Cr2O7 | Хромовая Дихромовая | Na2CrO4 K2Cr2O7 | Хромат натрия Дихромат калия | |
| FeO3 | H2FeO4 | - | K2FeO4 | Феррат калия | |
| SiO2 | H2SiO3 | Кремниевая | CaSiO3 | Силикат кальция | |
| - | HF | Фтороводородная (плавиковая) | AlF3 | Фторид алюминия | |
| - | HCl | Хлороводородная (соляная) | CuCl2 | Хлорид меди (+2) | |
| - | HBr | Бромоводородная | NaBr | Бромид натрия | |
| - | HI | Йодоводородная | KI | Йодид калия | |
| - | H2S | Сероводородная | Cr2S3 | Сульфид хрома (+3) | |
| - | HCN | Циановодородная (синильная) | KCN | Цианид калия (цианистый калий) |
* - не все оксиды выделены и известны.
Амфотерные оксиды
| Формула оксида | Формула гидроксида | Название гидроксида | Формула соли | Название соли |
| BeO | Be(OH)2 H2BeO2 | Гидроксид берилия Бериллиевая кислота | BeCl2 Na2BeO2 | Хлорид бериллия Бериллат натрия |
| ZnO | Zn(OH)2 H2ZnO2 | Гидроксид цинка Цинковая кислота | ZnSO4 K2ZnO2 | Сульфат цинка Цинкат калия |
| Al2O3 | Al(OH)3 H3AlO3 H АlO2 | Гидроксид алюминия Ортоалюминиевая кислота Метаалюминиевая кислота | Al(NO3)3 Na3AlO3 K AlO2 | Нитрат алюминия Ортоалюминат натрия Метаалюминат калия |
| Cr2O3 | Cr(OH)3 H3 CrO3 H CrO2 | Гидроксид хрома (III или +3) Ортохромистая кислота Метахромистая кислота | Сr2(SO4)3 Li3CrO3 NaCrO2 | Сульфат хрома (+3) Ортохромит лития Метахромит натрия |
| Fe2O3 * | Fe(OH)3 H3FeO3 H FeO2 | Гидроксид железа (III или +3) Ортожелезистая Кислота Метажелезистая кислота | FeBr3 Na3FeO3 K FeO2 | Бромид железа (+3) Ортоферрит натрия Метаферрит калия |
| PbO | Pb(OH)2 H2PbO2 | Гидроксид свинца (II или +2) Свинцовистая кислота | PbCl2 Na2PbO2 | Хлорид свинца (+2) Плюмбит натрия |
| PbO2 | Pb(OH)4 H4PbO4 H2PbO3 | Гидроксид свинца (IV или +4) Ортосвинцовая кислота Метасвинцовая кислота | Pb(NO3)4 K4PbO4 Na2PbO3 | Нитрат свинца (+4) Ортоплюмбат калия Метаплюмбат натрия |
* - в большей степени проявляет основные свойства
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основные источники:
1. Пустовалова Л.М., Никанорова И.Е.Неорганическая химия. Ростов-н/Д. Феникс, 2012 г, 448 с. Гриф МО РФ.
Дополнительные источники:
1. Н.П. Глинка. Общая химия. – М.: Интеграл-Пресс, 2008 г, 240с.
Интернет – ресурсы:
1. www.hemi.nsu.ru
2. www.xumuk.ru
ФАРМАЦЕВТИЧЕСКИЙ ФИЛИАЛ
ГБОУ СПО «СВЕРДЛОВСКИЙ ОБЛАСТНОЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
Кафедра химии и фармацевтической технологии
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Учебное пособие для самостоятельной работы студентов по учебной дисциплине «Общая и неорганическая химия»
Екатеринбург
2012
Пособие для самостоятельной работы студентов по общей и неорганической химии / сост. преподаватель химии, кандидат химических наук А.И. Серебрякова. – Екатеринбург; Фармацевтический филиал ГБОУ СПО «СОМК», 2012. – 34 с.
Рецензент: Л.И. Русинова доцент УГТУ - УПИ, кандидат химических наук
Учебное пособие предназначено для самостоятельной работы студентов. Пособие содержит два раздела. В первом разделе рассматривается классификация, номенклатура, свойства неорганических соединений. Приведены примеры веществ различных классов, даны задания для самостоятельной работы. Второй раздел посвящен сложным веществам координационного строения – комплексным соединениям, которые широко используются в качестве аналитических реагентов в фармацевтическом анализе. Данное пособие позволяет повторить материал о классах соединений и подготовиться изучению учебной дисциплине Аналитическая химия и ПМ 02 МДК 02.02. «Контроль качества лекарственных средств».
Учебное пособие рассмотрено на заседании кафедры химии и фармацевтической технологии (протокол № 2 от 07 сентября 2012 года)
СОДЕРЖАНИЕ
I.Основы классификации неорганических соединений
|
| Поделиться: |


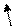
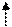


 29Сu +29))))
29Сu +29))))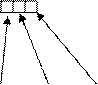

 Cu2+ )))) ↑↓ ↑↓ ↑↓ ↑↓ ↑ 4p0
Cu2+ )))) ↑↓ ↑↓ ↑↓ ↑↓ ↑ 4p0




 2 8 17 0 3d9
2 8 17 0 3d9