Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодический закон и периодическая система химических элементов Д. И. МенделееваСтр 1 из 3Следующая ⇒
Изменение атомного радиуса В группах: для элементов главных подгрупп сверху вниз увеличивается число энергетических уровней. Энергетический уровень – это и есть расстояние, на котором находится электрон от ядра. Значит, по группе вниз атомный радиус увеличивается. В периодах: по периоду номер энергетического уровня, на котором находятся валентные электроны, остается неизменным, но число валентных электронов увеличивается, а также растет и заряд ядра. Значит, электроны электростатически сильнее притягиваются к ядру. Поэтому радиус атома уменьшается. Электроотрицательность Электроотрицательность – это способность атома перетягивать на себя электроны связи. Это величина, которая отражает «желание» атома отдать свои валентные электроны или принять чужие валентные электроны. Чем выше электроотрицательность, тем сильнее атом хочет принять чужие валентные электроны. Существует несколько основных шкал электроотрицательности. Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом. Электроотрицательность (X) измеряется в относительных величинах (таблица 4).
Таблица 4. Электроотрицательности (X) некоторых элементов. Данные из справочника: CRS Handbook of Chemistry and Physics (издание 2007 года).
Электроотрицательность по Полингу – это свойство атомов, связанных химическими связями, т. е. находящихся в составе химических соединений. Соединения таких благородных элементов, как гелий, неон и аргон до сих пор не получены, поэтому не определена и ЭО этих элементов. Однако в полной таблице в приложении VII уже можно найти значения для ксенона (Xe), соединения которого с фтором и кислородом известны с 60-х годов ХХ века. Наибольшей электроотрицательностью обладают элементы, находящиеся в правом верхнем углу Периодической системы. Соответственно, наименьшей – элементы, находящиеся в нижнем левом углу. Аналогично меняются и металлические свойства простых веществ, образованных данными элементами. Металлы легко отдают свои валентные электроны, соответственно, они имеют низкую электроотрицательность. Поэтому металлы находятся в нижнем левом углу Периодической системы, а типичные неметаллы – в правом верхнем.
Обобщение закономерностей изменения свойств в таблице Закономерности изменения периодических свойств приведены в табл. 5.
История развития представлений о строении веществ Теория строения органических веществ А.М. Бутлерова Предположения Ф. Кекуле Человеком, который преодолел заблуждения тогдашних авторитетов, стал молодой русский ученый Александр Михайлович Бутлеров (1828–1886). Рис. 1.
Рис. 1. А.М. Бутлеров
Главные положения своей теории химического строения Бутлеров впервые изложил в докладе «О химическом строении вещества», прочитанном в химической секции Съезда немецких естествоиспытателей и врачей в Шпейере (сентябрь 1861 г.). Основы этой теории сформулированы таким образом: 1. «Полагая, что каждому химическому атому свойственно лишь определённое и ограниченное количество химической силы (сродства), с которой он принимает участие в образовании тела, я назвал бы химическим строением эту химическую связь, или способ взаимного соединения атомов в сложном теле» 2. «… химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением» С этими основными постулатами связаны и все остальные положения классической теории химического строения. Бутлеров наметил путь для определения химического строения и сформулировал правила, которыми можно при этом руководствоваться.
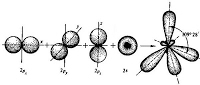
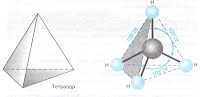
Бутлеров впервые объяснил явление изомерии тем, что изомеры – это соединения, обладающие одинаковым элементарным составом, но различным химическим строением. В свою очередь, зависимость свойств изомеров и вообще органических соединений от их химического строения объясняется существованием в них передающегося вдоль связей «взаимного влияния атомов», в результате которого атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Самим Бутлеровым и особенно его учениками В.В. Марковниковым и А.Н. Поповым это общее положение было конкретизировано в виде многочисленных «правил». Уже в XX в. эти правила, как и вся концепция взаимного влияния атомов, получили электронную интерпретацию. Явление гибридизации 1) sp 3 – гибридизация Происходит смешение одной s и трёх p орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи. Анимация: “Основные типы гибридизации атома углерода. SP3-гибридизация” SP3 - Гибридизация
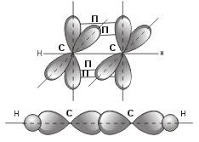
Рис. Строение молекулы метана СН4 (тетраэдрическое) 2) sp 2 – гибридизация: Происходит смешение одной s и двух p орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно друг друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам треугольника. Образуются 3 ковалентные σ – связи. Анимация: “SP2- гибридизация” sp2-Гибридизация
Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования σ – связей и участвует в образовании П - связи.
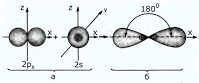
Рис. Строение молекулы этилена С2Н4 (плоское тригональное) 3 ) sp – гибридизация Происходит смешение одной s и одной p орбитали. Образуются две одинаковые гибридные орбитали, они расположены относительно друг друга под углом 180˚, лежат на одной линии. Образуются 2 ковалентные σ – связи. Анимация: “SP-гибридизация” SP - Гибридизация
Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях и образуют две П - связи.
Рис. Строение молекулы ацетилена С2Н2 (линейное)
Направленность гибридных орбиталей в пространстве, а следовательно, и геометрическое строение молекул зависят от типа гибридизации. На форму молекулы в пространстве влияет направленность только σ – связей. Типы гибридизации Пример №1 С-4H4 C-3H3 – C-3H3 C-2H2=C-2H2 C-1H ≡ C –1H Пример №2 Укажите степени окисления всех элементов в CH3CH2OH Решение. Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы (СН3 –). Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность углерода превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3. Атом С в составе группы -СН2ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С-3H+13C-1H+12O-2H+1. Периодический закон и периодическая система химических элементов Д.И. Менделеева Предпосылки открытия периодического закона В период становления науки химии ученые пытались привести в систему сведения об известных к тому времени нескольких десятков химических элементов. Эта проблема увлекла и Д.И. Менделеева. Он искал закономерности и взаимосвязи, которые бы охватывали все элементы, а не только часть из них. Менделеев считал важнейшей характеристикой элемента массу его атома. Проанализировав все известные к тому времени сведения о химических элементах и расположив их в порядке возрастания их атомных масс, в 1869 году он сформулировал периодический закон. Формулировка закона: свойства химических элементов, простых веществ, а также состав и свойства соединений находятся в периодической зависимости от значения атомных масс. К моменту формулировки периодического закона еще не было известно строение атома и существования элементарных частиц. Также впоследствии было установлено, что от атомных масс свойства вещества не зависят, как это предполагал Менделеев. Хотя, не обладая этими сведениями, Д. И. Менделеев не сделал в своей таблице ни единой ошибки. После открытия Мозли, который установил экспериментально, что заряд ядра атома совпадает с порядковым номером химического элемента, указанным Менделеевым в его таблице, в формулировку его закона внесли изменения. Описание периодической системы Современная формулировка закона: свойства химических элементов, простых веществ, а также состав и свойства соединений находятся в периодической зависимости от значений зарядов ядер атомов.
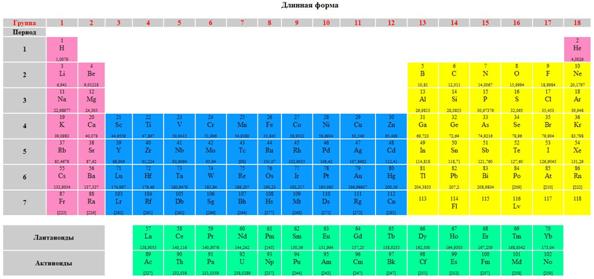
Рис. 1. Графическим выражением периодического закона является Периодическая система химических элементов Д. И. Менделеева
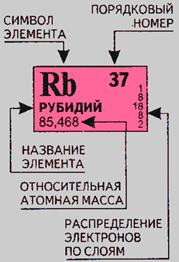
Рис. 2. Рассмотрим принятые в ней обозначения на примере рубидия
В каждой ячейке, соответствующей элементу, представлены: химический символ, название, порядковый номер, соответствующий числу протонов в атоме, относительная атомная масса. Число электронов в атоме соответствует числу протонов. Количество нейтронов в атоме можно найти по разности между относительной атомной массой и количеством протонов, т. е. порядкового номера.
N(n0) = Ar - Z Количество относительная порядковый нейтронов атомная масса номер элемента Например, для изотопа хлора 35Cl количество нейтронов равно: 35-17= 18 Составными частями периодической системы являются группы и периоды. Периодическая система содержит восемь групп элементов. Каждая группа состоит их двух подгрупп: главной и побочной. Главные обозначены буквой а, а побочные – буквой б. Главная подгруппа содержит больше элементов, чем побочная. В главной подгруппе содержатся s- и p-элементы, в побочной – d-элементы. Понятия о группах и периодах Группа – столбец периодической системы, в котором объединены химические элементы, обладающие химическим сходством вследствие сходных электронных конфигураций валентного слоя. Это основополагающий принцип построения периодической системы. Рассмотрим это не примере элементов первых двух групп. Табл. 1
Из таблицы видно, что элементы первой группы главной подгруппы имеют один валентный электрон. Элементы второй группы главной подгруппы имеют два валентных электрона. Некоторые главные подруппы имеют свои особенные названия: Табл. 2
Строка, называемая периодом, - это последовательность элементов, расположенных в порядке увеличения зарядов их ядер, которая начинается с щелочного металла (или водорода) и заканчивается благородным газом. Номер периода равен количеству электронных уровней в атоме. Существует два основных варианта представления периодической системы: длиннопериодный, в котором выделяют 18 групп (Рис. 3) и короткопериодный, в котором групп 8, но вводится понятие главной и побочной подгрупп (Рис. 1).
Рис. 3 Электронные конфигурации валентного слоя некоторых атомов Периодическая повторяемость строения валентных электронов в атоме – это важнейший критерий, который объясняет и предсказывает свойства многих элементов. См. табл. 3. Табл. 3
У каждой группы есть формула высшего оксида, т. е. оксида с максимальной степенью окисления элементов. Эта информация написана внизу таблицы. Например, для элементов V группы формула высшего оксида – R2O5. Это N2O5, P2O5, As2O5, V2O5…. По составу высшего оксида элемента можно определить его свойства. Оксиды состава R2O, RO основные. R2O3 - чаще всего амфотерные. Остальные оксиды – кислотные. Чем выше степень окисления элемента R, чем ярче выраженными кислотными свойствами обладает его оксид. Таким образом, кислотность высших оксидов элементов главных подгрупп увеличивается по периоду слева направо.
В таблице отражен состав летучих водородных соединений. Такие соединения образуют элементы IV-VII групп, причем только легких. Изменение атомного радиуса В группах: для элементов главных подгрупп сверху вниз увеличивается число энергетических уровней. Энергетический уровень – это и есть расстояние, на котором находится электрон от ядра. Значит, по группе вниз атомный радиус увеличивается. В периодах: по периоду номер энергетического уровня, на котором находятся валентные электроны, остается неизменным, но число валентных электронов увеличивается, а также растет и заряд ядра. Значит, электроны электростатически сильнее притягиваются к ядру. Поэтому радиус атома уменьшается. Электроотрицательность Электроотрицательность – это способность атома перетягивать на себя электроны связи. Это величина, которая отражает «желание» атома отдать свои валентные электроны или принять чужие валентные электроны. Чем выше электроотрицательность, тем сильнее атом хочет принять чужие валентные электроны. Существует несколько основных шкал электроотрицательности. Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом. Электроотрицательность (X) измеряется в относительных величинах (таблица 4).
Таблица 4. Электроотрицательности (X) некоторых элементов. Данные из справочника: CRS Handbook of Chemistry and Physics (издание 2007 года).
Электроотрицательность по Полингу – это свойство атомов, связанных химическими связями, т. е. находящихся в составе химических соединений. Соединения таких благородных элементов, как гелий, неон и аргон до сих пор не получены, поэтому не определена и ЭО этих элементов. Однако в полной таблице в приложении VII уже можно найти значения для ксенона (Xe), соединения которого с фтором и кислородом известны с 60-х годов ХХ века. Наибольшей электроотрицательностью обладают элементы, находящиеся в правом верхнем углу Периодической системы. Соответственно, наименьшей – элементы, находящиеся в нижнем левом углу. Аналогично меняются и металлические свойства простых веществ, образованных данными элементами. Металлы легко отдают свои валентные электроны, соответственно, они имеют низкую электроотрицательность. Поэтому металлы находятся в нижнем левом углу Периодической системы, а типичные неметаллы – в правом верхнем. Обобщение закономерностей изменения свойств в таблице Закономерности изменения периодических свойств приведены в табл. 5.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 147; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.190.102 (0.049 с.) |